-
下列表述正确的是
A.用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
B.超导材料AB2在熔融状态下能导电,说明AB2是电解质
C.推广使用煤液化技术可以减少温室气体二氧化碳的排放
D.人体摄入的糖类、油脂、蛋白质均必须先经过水解才能被吸收
难度: 简单查看答案及解析
-
用下列方案及所选玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
选项
实验目的
实验方案
所选玻璃仪器
A
除去KNO3固体中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
测定海带中是否含有碘
将海带剪碎,加蒸馏水浸泡,取滤液加入淀粉溶液
试管、胶头滴管、烧杯、
漏斗
C
测定待测溶液中I-的浓度
量取20.00ml的待测液,用0.1mol·L-1的FeC13溶液滴定
锥形瓶、碱式滴定管、量筒
D
配制500mL1mol/LNaOH溶液
将称量好的20.0gNaOH固体、溶解、冷却、转移、洗涤、定容、摇匀
烧杯、玻璃棒、量筒、
500ml.容量瓶、胶头滴管
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
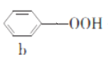
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是
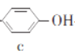 +
+A.a、b、c均属于芳香烃 B.a、d中所有碳原子均处于同一平面上
C.A有9种属于芳香族的同分异构体 D.c、d均能发生氧化反应
难度: 简单查看答案及解析
-
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是常见的大气污染物。下列有关判断不正确的是
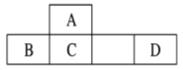
A.A的简单氢化物是天然气的主要成分
B.元素A、B、C对应的含氧酸的钠盐水溶液不一定显碱性
C.单质B既可以与酸反应,又可以与碱反应,所以是两性单质
D.最高价氧化物对应的水化物的酸性:D>C
难度: 简单查看答案及解析
-
新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该科技实现了H2S废气资源回收能量,并H2S得到单质硫的原理如图所示。下列说法正确的是

A.电极a为电池正极
B.电路中每流过4mol电子, 正极消耗1molO 2
C.电极b上的电极反应:O2+4e-+4H+=2H2O
D.电极a上的电极反应:2H2S+2O2――2e―=S2+2H2O
难度: 简单查看答案及解析
-
某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是

①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去 ②装置I中充满黄绿色气体后,再加热盛有铝粉的硬质玻璃管 ③装置II是收集装置,用于收集氯化铝④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同 ⑤a处使用较粗的导气管实验时更安全
A.①② B.②③⑤ C.①④ D.③④⑤
难度: 中等查看答案及解析
-
常温下, 用0.100mol·L-1NaOH溶液分别滴定20.00mL0.100mol·L-1的HA溶液和HB溶液的滴定曲线如图。下列说法错误的是(己知lg2≈0.3)
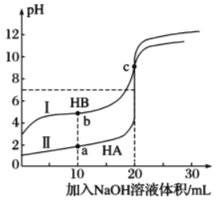
A.HB是弱酸,b点时溶液中c(B-)>c(Na+)>c(HB)
B.a、b、c三点水电离出的c(H+):a>b>c
C.滴定HB溶液时,应用酚酞作指示剂
D.滴定HA溶液时, 当V(NaOH)=19.98mL时溶液pH约为4.3
难度: 中等查看答案及解析
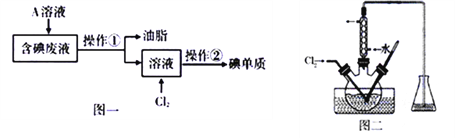
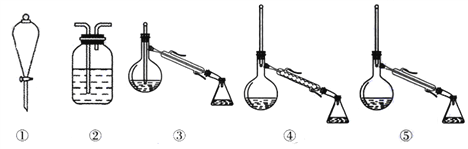
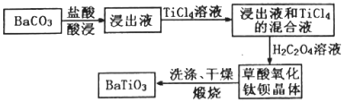

 )的流程如图:
)的流程如图: )
)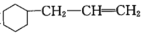 )
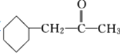
)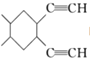 的合成线路(其他试剂任选)__________。
的合成线路(其他试剂任选)__________。