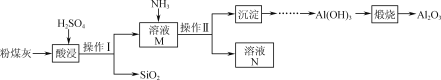
-
5G时代对于信息的传输、储存、处理技术提出了新的要求。某种三维存储器的半导体衬底材料是单晶硅。下列化学式中可用于表示单晶硅的是( )
A.Si B.H2SiO3
C.Na2SiO3 D.SiO2
难度: 简单查看答案及解析
-
“g·mol-1”是一个物理量的单位,这个物理量是( )
A.物质的量 B.摩尔质量
C.气体摩尔体积 D.物质的量浓度
难度: 简单查看答案及解析
-
下列变化不属于化学变化的是( )
A.冰雪融化 B.油脂皂化
C.石油裂化 D.煤的液化
难度: 简单查看答案及解析
-
当光束通过下列分散系时,能产生丁达尔效应的是( )
A.白醋 B.医用酒精
C.蛋白质溶胶 D.饱和食盐水
难度: 简单查看答案及解析
-
分别灼烧下列各组溶液,火焰呈黄色的是( )
A.Na2CO3溶液 B.CuCl2溶液
C.稀盐酸 D.KCl溶液
难度: 简单查看答案及解析
-
科学家运用铝(
)铍(
)测年法确定了“北京人”的年龄。下列关于
的说法正确的是( )
A.核外电子数为6 B.中子数为4
C.质子数为10 D.核电荷数为4
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
A.NaCl的电离方程式:NaCl=Na++Cl- B.氧原子的结构示意图:
C.苯的结构式:
D.氟化氢的电子式:H+[
]-
难度: 简单查看答案及解析
-
中美科学家携手发现了全硼富勒烯B40团簇(如图结构),它在储氢储锂、半导体、超导、绿色催化等领域具有重要的应用。 B40属于( )
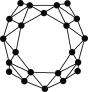
A.单质
B.化合物
C.有机物
D.氧化物
难度: 简单查看答案及解析
-
下列常见物质的俗名与化学式相对应的是( )
A.小苏打——Na2SO4 B.明矾——Al2(SO4)3
C.天然气——CH4O D.烧碱——NaOH
难度: 简单查看答案及解析
-
下列气体排放到空气中,会导致酸雨的是( )
A.CH4 B.NH3
C.N2 D.NO2
难度: 简单查看答案及解析
-
在含有大量Na+、Cl-、HCO3-的溶液中,还可能大量存在的离子是( )
A.Ag+ B.OH-
C.NO3- D.H+
难度: 简单查看答案及解析
-
下列物质属于共价化合物的是( )
A.H2 B.NH4Cl
C.CO2 D.K2O
难度: 简单查看答案及解析
-
下列物质属于高分子化合物的是( )
A.葡萄糖 B.纤维素
C.氨基酸 D.乙烯
难度: 简单查看答案及解析
-
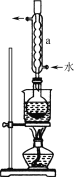
下列实验装置与操作都正确的是( )
A.
 蒸馏海水 B.
蒸馏海水 B. 配制150mL稀盐酸
配制150mL稀盐酸C.
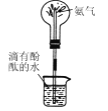 制造无色喷泉 D.
制造无色喷泉 D. 蒸发结晶
蒸发结晶难度: 简单查看答案及解析
-
1828年,德国化学家维勒在制备氰酸铵(NH4CNO)时得到了尿素[CO(NH2)2],首次人工合成有机物。NH4CNO与CO(NH2)2两者互为( )
A.同位素 B.同分异构体
C.同系物 D.同素异形体
难度: 简单查看答案及解析
-
下列关于乙醇与乙酸的说法正确的是( )
A.都含有碳氧双键
B.都能与碳酸钠溶液反应
C.两者所含碳元素的百分含量相同
D.乙醇在一定条件下可转化为乙酸
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.锌与CH3COOH溶液反应:Zn+2H+=Zn2++H2↑
B.氢氧化镁与稀硝酸反应:H++OH-=H2O
C.Na与水反应:2Na+2H2O=2Na++2H2↑+O2↑
D.Cu与FeCl3溶液反应:Cu+2Fe3+=Cu2++2Fe2+
难度: 简单查看答案及解析
-
某铁—空气电池放电时,其原理如图所示。电池总反应为2Fe+O2+2H2O=2Fe(OH)2。下列说法正确的是( )
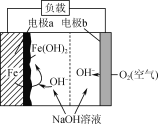
A.a极质量不变
B.b极为电池负极
C.电子从a电极经负载流向b电极
D.该装置将电能转变为化学能
难度: 简单查看答案及解析
-
下列有机反应属于取代反应的是( )
A.2CH3CH2OH+O2
2CH3CHO+2H2O
B.CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
C.CH2=CH2+HBr→CH3CH2Br
D.nCH2=CH2
难度: 简单查看答案及解析
-
下列实验方案能达到目的的是( )
A.用碱石灰干燥氯气
B.用品红溶液鉴别CO2和SO2
C.用乙醇萃取碘水中的碘单质
D.用澄清石灰水检验碳酸氢钠溶液中是否含有碳酸钠
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。 X的单质在空气中所占体积分数最大,Y是地壳中含量最多的金属元素,Z与X位于同一主族,W原子的最外层有7个电子。下列说法正确的是( )
A.X位于元素周期表中第2周期第ⅥA族
B.原子半径:r(W)>r(Z)>r(Y)>r(X)
C.W的简单气态氢化物的热稳定性比Z的强
D.Z的最高价氧化物对应水化物的酸性比X的强
难度: 简单查看答案及解析
-
根据下列实验操作和现象,所得结论正确的是( )
选项
操作
现象
结论
A
将两根打磨光亮的镁条分别插入硫酸铜溶液和硝酸银溶液
两根镁条上均有固体附着
金属的活动性顺序为Mg>Cu>Ag
B
将铝片插入盛有浓硫酸的试管中
无明显现象
铝与浓硫酸不反应
C
将KSCN溶液滴入盛有无色溶液的试管中
溶液变为血红色
溶液中含有Fe3+
D
加热盛有淀粉和稀硫酸的试管一段时间,冷却后滴入碘水
溶液变为蓝色
淀粉未水解
A.A B.B C.C D.D
难度: 简单查看答案及解析
 。
。