-
Na2S2O3·5H2O俗称“海波”,在医疗、化工等行业有重要用途。其在碱性或中性环境中能稳定存在,酸性溶液中发生反应:S2O32-+2H+=H2O+SO2↑+S↓。实验室可用如图所示装置进行制备(部分夹持装置略去),步骤如下:
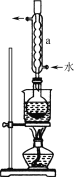
步骤1 称取63.0 g Na2SO3加入圆底烧瓶中,再加入400 mL蒸馏水配成溶液。另取一定量的硫粉加入乙醇中搅拌,再与上述溶液混合。
步骤2 安装实验装置,水浴加热,微沸60 min。
步骤3 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥;得到粗产品。
(1)仪器a的名称________。
(2)实验过程中乙醇仅作为溶剂,不参与反应。请写出步骤2中的化学方程式:________。
(3)粗产品中除了有未反应的Na2SO3外,可能含有Na2SO4杂质。请设计实验检验粗产品中是否含有SO42-:________。
(4)依据下列实验可确定所得粗产品中Na2S2O3·5H2O和Na2SO3比例。
称取三份质量不同的粗产品,分别加入相同浓度的硫酸溶液30 mL,充分反应后滤出硫(反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O),微热滤液使SO2全部逸出。测得有关实验数据如下表所示(气体体积已换算为标准状况)。
| 实验数据 | 第一份 | 第二份 | 第三份 |
| 样品的质量/g | 3.415 | 6.830 | 15.000 |
| 二氧化硫气体的体积/L | 0.336 | 0.672 | 1.344 |
| 硫的质量/g | 0.400 | 0.800 | 1.600 |
①所用硫酸溶液的物质的量浓度为________。
②计算所得粗产品中n(Na2S2O3·5H2O)和n(Na2SO3)的比值,并写出计算过程____________。
-
(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
为测定产品纯度,进行了如下实验:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为:2S2O32+I2==S4O62+2I-

请填写下列空白:
①用标准碘溶液滴定待测溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________________。滴定至终点时,溶液颜色________,且半分钟内保持不变,即停止滴定。
②测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________________________________
③下列操作中可能使所测产品的纯度数值偏低的是________(填字母)。
A.酸式滴定管未用标准碘溶液润洗就直接注入标准碘溶液
B.滴定前,锥形瓶用蒸馏水洗涤后,未用待测的溶液润洗就做滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取标准碘溶液体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________。
-
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
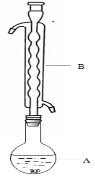
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
-
硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:
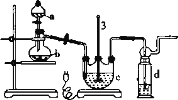
(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%〜80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
| 装置 | 试剂X | 实验现象 |
| 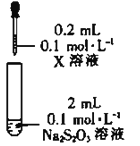
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______mol∙L-1
-
维生素C的结构是:预测其化学性质不可能有的是
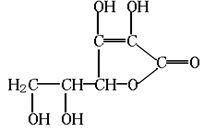
A.能发生氧化反应
B.能使酸性KMnO4溶液褪色
C.能发生加成反应
D.在碱性溶液中能稳定地存在
-
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O的装置和部分操作步骤如图所示。
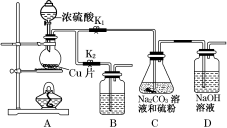
Ⅰ.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①步骤Ⅰ中,圆底烧瓶内发生反应的化学方程式是_________________。
②步骤Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是____________。“停止C中的反应”的操作是____________________________________。
③装置B中盛放的试剂是________溶液(填化学式),其作用是___________________。
(2)依据反应2S2O+I2=S4O+2I-,可用I2的标准溶液测定产品的纯度。取5.5 g产品,配制成100 mL溶液。取10 mL溶液,以淀粉溶液为指示剂,用浓度为0.050 mol·L-1的标准溶液进行滴定,相关数据记录如表所示。
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
①判断达到滴定终点的现象是__________________________________________。
②Na2S2O3·5H2O(式量M=248)在产品中的质量分数是(计算结果保留1位小数)________。
-
硫代硫酸钠(Na2S2O3·5H2O),俗称大苏打,是无色透明晶体,易溶于水,易被氧化。是一种重要的化工产品,临床上用于氰化物的解毒剂,工业上也用于纸浆漂白的脱氯剂。某兴趣小组在实验室用如下装置(夹持仪器略去)模拟硫代硫酸钠生产过程。
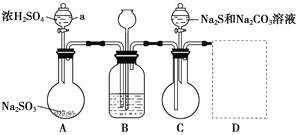
(1)仪器a的名称为_________。
(2)装置A中发生反应的化学方程式为_____________________________。
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2CO3恰好完全反应,则烧瓶C中Na2S和Na2CO3物质的量之比为____________。
(4)装置B中盛有饱和NaHSO3溶液,装置B的作用是_________、__________。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。
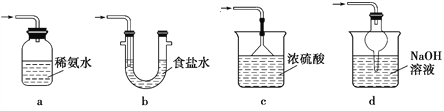
(6)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
已知:Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。
限选试剂:稀HNO3、稀H2SO4、稀HCl、蒸馏水
-
硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图a所示。
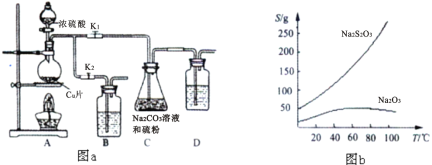
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图b所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是____________________。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的_________。(填编号)
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH在7—10时,打开K2、关闭K1并停止加热;C中溶液要控制pH的原因是____________。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液__________、过滤、________、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检验反应后溶液中含有硫酸根,写出该反应的化学方程式____________________________________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O I2+2S2O32-=S4O62-+2I-,则该废水中Ba2+的物质的量浓度为_______________。
-
硫代硫酸钠又名大苏打、海波,可以用于治疗氰化物中毒等,某化学兴趣小组通过查阅资料,设计了如下的装置(略去部分夹持仪器)来制取Na2S2O3·5H2O晶体并探究其性质。
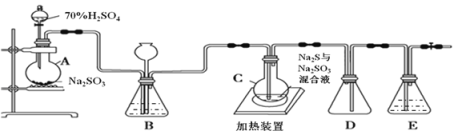
已知烧瓶C中发生如下三个反应:
Na2S(aq)+H2O(l)+SO2(g) = Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g) =3S(s)+2H2O(l) ;S(s)+Na2SO3(aq)  Na2S2O3(aq)
Na2S2O3(aq)
(1)装置B的作用之一是观察SO2的生成速率。控制SO2生成速率可以采取的措施有_________________________(写一条)
(2)常温下,用pH试纸测定0.1 mol·L-1 Na2S2O3溶液pH值约为8,测定时的具体操作是_______________________________。
(3)向新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,有硫酸根离子生成,写出该反应的离子方程式_____________________。
-
(10分)硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂。Na2S2O3易溶于水,在酸性溶液中会迅速发生反应。
(1)完成Na2S2O3溶液与稀硫酸混合反应的化学方程式:________
该反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5mL):
| 实验 编号 | T/K | c(Na2S2O3)/mol·L-1 | c(H2SO4) /mol·L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响。 |
| ② | 308 | ① | ② |
| ③ | ③ | 0.2 | ④ |
| ④ | ⑥ | 0.1 | ⑥ |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为_______________________。(S元素被氧化为SO42-)










