-
从古至今化学与生产、生活密切相关。下列说法正确的是( )
A.宋朝王希孟的画作《千里江山图》所用纸张为宣纸,其主要成分是碳纤维
B.汉代烧制出“明如镜、声如罄”的瓷器,其主要原料为石灰石
C.“司南之杓(勺),投之于地,其柢(勺柄)指南”中的“杓”含Fe2O3
D.港珠澳大桥使用的聚乙烯纤维吊绳是有机高分子化合物
难度: 简单查看答案及解析
-
咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
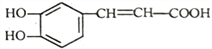
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol 咖啡酸最多能与5 mol H2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A 的分子式为C8H10O
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
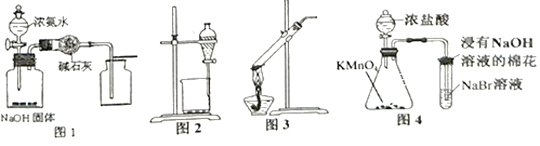
A. 用图1所示装置制取并收集少量纯净的氨气
B. 用图2 所示装置分离乙醇和乙酸乙酯的混合溶液
C. 用图3所示装置加热分解NaHCO3固体
D. 用图4 所示装置比较KMnO4、Cl2、Br2的氧化性强弱
难度: 中等查看答案及解析
-
中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是( )
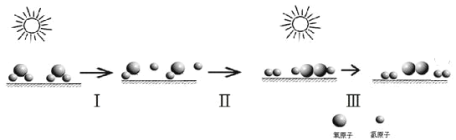
A.整个过程实现了光能向化学能的转换
B.过程Ⅱ有O-O单键生成并放出能量
C.过程Ⅲ发生的化学反应为:2H2O2═2H2O+O2
D.整个过程的总反应方程式为:2H2O→2H2+O2
难度: 简单查看答案及解析
-
某科研小组将含硫化氢的工业废气进行了资源化利用,将获得的电能用于制取“84”消毒液。已知:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H= -632 KJ/ mol。下图为该小组设计的原理图。下列说法正确的是 ( )
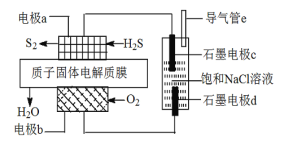
A.电极a为燃料电池正极
B.电极b上发生的电极反应为:O2+4e-+2H2O=4OH-
C.电路中每流过4mol电子,电池质子固体电解质膜饱和NaCl溶液内部释放热能小于632kJ
D.a极每增重32g,导气管e将收集到气体22.4L
难度: 简单查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素。W、Y是金属元素,Z的原子序数是X的2倍。Q与W同主族,且Q与W形成的离子化合物中阴、阳离子电子层结构相同。Q与X形成的简单化合物的水溶液呈碱性。Y的氧化物既能与强酸溶液反应又与强碱溶液反应。下列说法不正确的是
A.Q与X形成简单化合物的分子为三角锥形
B.Z的氧化物是良好的半导体材料
C.原子半径Y>Z>X>Q
D.W与X形成化合物的化学式为W3X
难度: 中等查看答案及解析
-
常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=
]下列说法正确的是
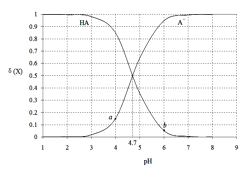
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
难度: 简单查看答案及解析
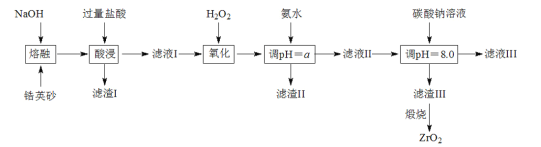
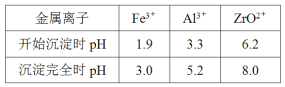
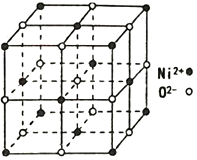
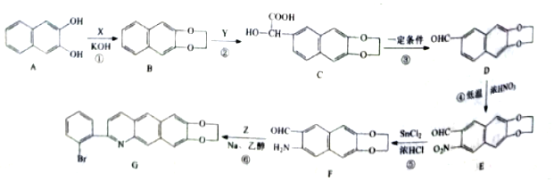
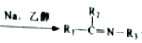 +H2O
+H2O 的流程图。____
的流程图。____