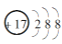-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6,-2
+2
-2
下列叙述正确的是( )
A.离子半径大小:r(M3+)>r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质在氧气中燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
难度: 中等查看答案及解析
-
下列实验操作中叙述正确的是
A.萃取操作必须在分液漏斗中进行
B.漏斗、试管、蒸馏烧瓶、天平、分液漏斗、研钵常用于物质分离
C.用剩的药品均不能放回原试剂瓶中
D.分液时,分液漏斗内下层液体从下口放出,上层液体从上口倒出
难度: 简单查看答案及解析
-
元素性质呈现周期性变化的根本原因是
A.原子半径呈周期性变化 B.元素化合价呈周期性变化
C.元素的相对原子质量 D.元素原子的核外电子排布呈周期性变化
难度: 简单查看答案及解析
-
下列有关叙述中,能说明非金属元素M比N的非金属性强的是( )
①非金属单质N能从M的化合物中置换出非金属单质M;
②M原子比N原子容易得到电子;
③N-离子的还原性比M-离子强;
④气态氢化物水溶液的酸性HmM>HnN;
⑤氧化物水化物的酸性HmMOx>HnNOy;
⑥单质熔点M>N。
A.②⑤
B.②③
C.①②③
D.①②③⑤
难度: 中等查看答案及解析
-
关于VA族元素(用R代表)的下列叙述正确的是
A.最高化合价是+5价 B.氢化物的通式为RH5
C.非金属性由上到下递增 D.其含氧酸均为一元强酸
难度: 简单查看答案及解析
-
下列事实中,能说明氯原子得电子能力比硫原子强的是
①盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ②HCl的稳定性比H2S大 ③Cl2与铁反应生成FeCl3 ,而S与铁反应生成FeS ④Cl2能与H2S反应生成S ⑤还原性:Cl-<S2-
A.①②③④ B.②③④ C.①②③④⑤ D.②③④⑤
难度: 中等查看答案及解析
-
在考古中常通过测定14C来鉴定文物年代,下列关于14C说法正确的是
A.质子数为7 B.中子数为8 C.核外电子数为7 D.原子序数为14
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.SiO2既可以和NaOH溶液反应,也可以和HF溶液反应,所以SiO2是两性氧化物
B.向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶
C.石英是良好的半导体材料,可以制成光电池
D.陶瓷的烧制不涉及化学变化
难度: 中等查看答案及解析
-
下列有关说法中正确的是
A.12C、13C、14C是碳的三种同素异形体
B.H2S的电子式可表示为
C.HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D.NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
难度: 简单查看答案及解析
-
核内中子数为N的R2+,质量数为A,则ng它的氧化物(RO)中所含质子的物质的量是( )
A.
(A-N+8) mol B.
(A-N+10)mol
C.(A-N+2)mol D.
(A-N+6)mol
难度: 中等查看答案及解析
-
甲、乙是周期表中同一周期的两种元素,甲在ⅡA族,乙在ⅢA族,那么甲、乙两元素的原子序数之差不可能是
A.1 B.11 C.25 D.10
难度: 中等查看答案及解析
-
在一定条件下,RO3-与R-可发生反应,RO3-+5R-+6H+=3R2+3H2O,下列关于R的叙述中,正确的是
A.R可能是金属
B.元素R位于周期表中第VA族
C.R形成的单质在常温常压下一定是气体
D.反应中氧化产物与还原产物的物质的量之比是5:1
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.气态氢化物的稳定性:Z>W
D.W的单质能与水反应,生成一种具有漂白性的物质
难度: 中等查看答案及解析
-
下列各组性质比较中,正确的是()
①沸点:
②离子还原性:
③酸性:
④金属性:
⑤气态氢化物稳定性:
⑥半径:
A.①②③ B.③④⑤⑥ C.②③④ D.①③④⑤⑥
难度: 中等查看答案及解析
-
关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在地球上元素的分布和它们在元素周期表中的位置有密切关系
C.在金属元素区域可以寻找制备新型农药材料的元素
D.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
难度: 简单查看答案及解析
-
如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是
A.
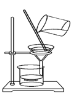 B.
B.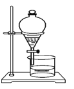 C.
C. D.
D.
难度: 简单查看答案及解析
-
下列说法正确的是
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
A.②③④ B.②④⑥ C.①③⑥ D.①③⑤
难度: 中等查看答案及解析