-
对于a、b、c、d四块金属片,若a、b用导线相连浸泡在稀H2SO4中,电子由a流向b;c、d用导线相连浸泡在稀H2SO4时,d产生大量气泡;a、c用导线相连浸泡在稀CuSO4中时,c上附着上一层红色物质;d浸泡在b的硝酸盐溶液中,置换出b的单质。由这四种金属的活动顺序由大到小为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是( )
A.HClO的结构式:H-Cl-O B.
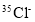 和
和 离子结构示意图均可以表示为:
离子结构示意图均可以表示为:
C.HF的电子式:
 D.质子数为92、中子数为146的U原子:
D.质子数为92、中子数为146的U原子: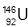
难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.
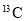 和
和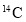 属于同种元素,它们互为同位素
属于同种元素,它们互为同位素B.
 和
和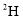 是不同的核素,它们的质子数相等
是不同的核素,它们的质子数相等C.
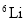 和
和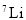 的电子数相等,中子数也相等
的电子数相等,中子数也相等D.
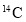 和
和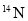 的质量数相等,它们的中子数不等
的质量数相等,它们的中子数不等难度: 中等查看答案及解析
-
已知1~18号元素的离子aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径:A>B>C>D
B. 离子半径:Cm->Dn->Bn+>Am+
C. 氢化物的稳定性:HmC>HnD
D. 单质的还原性:A>B>D>C
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
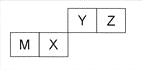
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第二周期、第ⅥA族
难度: 中等查看答案及解析
-
同一短周期X、Y、Z三种元素,已知其气态氢化物分别是HX、H2Y、ZH3,则下列判断错误的是( )
A. 热稳定性:HX>H2Y>ZH3 B. 还原性:HX>H2Y>ZH3
C. 酸性:H3ZO4<H2YO4<HXO4 D. 非金属性:X>Y>Z
难度: 简单查看答案及解析
-
根据表中7种短周期元素的有关信息判断,下列说法错误的是
元素编号



原子半径
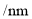

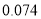
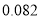
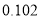
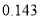
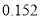
最高化合价或最低化合价
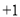


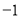


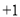
A. 元素
 气态氢化物的稳定性大于元素
气态氢化物的稳定性大于元素 气态氢化物的稳定性
气态氢化物的稳定性B. 元素
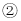 氢化物的沸点小于元素
氢化物的沸点小于元素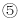 氢化物的沸点
氢化物的沸点C. 元素
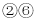 形成的化合物具有两性
形成的化合物具有两性D.
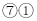 可形成离子化合物
可形成离子化合物难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是
A.
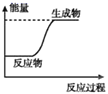
B.
C.

D.

难度: 简单查看答案及解析
-
X(g)+3Y(g)
 2Z(g) ΔH=-akJ·mol-1。一定条件下,将1 molX和3 molY通入2L的恒容密闭容器,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1。一定条件下,将1 molX和3 molY通入2L的恒容密闭容器,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是( )A.10 min内,Y的平均反应速率为0.03 mol·L-1·s-1
B.10 min内,消耗0.2 molX,生成0.4 molZ
C.第10 min时,X的反应速率为0.01 mol·L-1·min-1
D.10 min内,X和Y反应放出的热量为a kJ
难度: 中等查看答案及解析
-
反应
 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.保持容器体积不变,增加H2O(g)的量
B.保持容器体积不变,充入氦气使体系压强增大
C.将容器的体积缩小一半
D.保持容器压强不变,充入氦气使容器体积变大
难度: 简单查看答案及解析
-
银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其工作示意如图所示。下列说法不正确的是
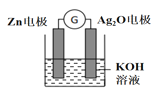
A.Zn电极是负极
B.工作时K+移向Zn电极
C.Ag2O电极发生还原反应
D.Zn电极的电极反应式:Zn-2eˉ+2OHˉ===Zn(OH)2
难度: 困难查看答案及解析
-
一定条件下,可逆反应2A(g)
 B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )选项
正反应速率
逆反应速率
A
v(A)=2mol·L-1·min-1
v(B)=2mol·L-1·min-1
B
v(A)=2mol·L-1·min-1
v(C)=2mol·L-1·min-1
C
v(A)=1mol·L-1·min-1
v(B)=2mol·L-1·min-1
D
v(A)=1mol·L-1·min-1
v(C)=1.5mol·L-1·min-1
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
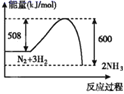
由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
A.1174.7kJ/mol B.700.2kJ/mol C.541.4kJ/mol D.391.6 kJ/mol
难度: 中等查看答案及解析
-
下列说法不正确的是( )
①
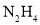 分子中既含极性键又含非极性键
分子中既含极性键又含非极性键②若
 和
和 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数:
③
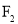 、
、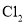 、
、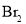 、
、 熔点随相对分子质量的增大而升高
熔点随相对分子质量的增大而升高④
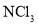 、
、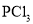 、
、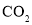 、
、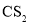 分子中各原子均达到
分子中各原子均达到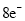 稳定结构
稳定结构⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥
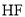 分子很稳定是由于
分子很稳定是由于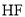 分子之间能形成氢键
分子之间能形成氢键⑦由于非金属性:
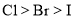 ,所以酸性:
,所以酸性:
A.②⑤⑥⑦ B.①③④⑤ C.②④⑤ D.③⑤⑦
难度: 中等查看答案及解析
-
实验室用含碘(主要以
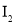 和
和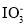 的形式存在)废水制备单质碘的实验流程如下:
的形式存在)废水制备单质碘的实验流程如下:
已知:I.碘的熔点为113℃,但固态碘易升华;
II.粗碘中含有少量的
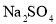 杂质。
杂质。下列说法正确的是( )
A.操作①和③中的有机相从分液漏斗上端倒出
B.操作②中发生反应的离子方程式为
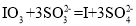
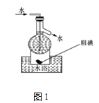
C.操作⑤可用图1所示的水浴装置进行
D.操作④为过滤
难度: 中等查看答案及解析
-
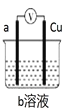
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
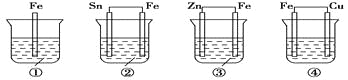
A.④②①③ B.④③①② C.②①③④ D.③②④①
难度: 中等查看答案及解析

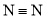 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
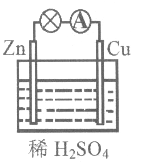
 向_____极移动;
向_____极移动;