-
下列反应能通过原电池的形式来实现的是
A.Cu+2Ag+=2Ag+Cu2+ B.Cu+2H+=H2↑+Cu2+
C.CaCO3+2HCl=CaCl2+CO2↑十H2O D.2H2O
 2H2↑+O2↑
2H2↑+O2↑难度: 简单查看答案及解析
-
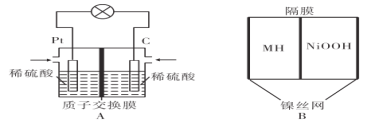
将相同的锌片和铜片按图示方式插入同浓度的稀硫酸中,以下叙述正确的是
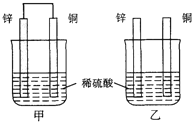
A.两烧杯中铜片表面均无气泡产生 B.两烧杯中溶液的H+浓度都减小
C.产生气泡的速率甲比乙慢 D.甲中铜片是正极,乙中铜片是负极
难度: 简单查看答案及解析
-
下列体系加压后,对化学反应速率没有影响的是
A. 2SO2+O2
 2SO3 B. CO+H2O(g)
2SO3 B. CO+H2O(g) CO2+H2
CO2+H2C. CO2+H2O
 H2CO3 D. NaOH+HCl→NaCl+H2O
H2CO3 D. NaOH+HCl→NaCl+H2O难度: 中等查看答案及解析
-
在四个不同的密闭容器中,采用不同条件进行反应N2(g)+3H2(g)
 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是A. v(N2)=0.2mol/(L∙min) B. v(NH3)=0.3mol/(L∙min)
C. v(H2)=0.1mol/(L∙min) D. v(H2)=0.3mol/(L∙min)
难度: 中等查看答案及解析
-
化学反应体系中反应物、生成物的能量与活化能的关系如图所示。下列有关说法错误的是

A.E1是反应的活化能 B.E2是活化分子变成生成物分子放出的能量
C.能量差E1-E2是反应热 D.活化能的大小决定了反应热的大小
难度: 简单查看答案及解析
-
已知X、Y、Z三种物质的分子式相同,但分子的空间结构不同,可以实现下列转化:
1molX
 1molY
1molY 1molZ。下列说法正确的是( )
1molZ。下列说法正确的是( )A.物质Y比X稳定. B.物质Y比Z稳定
C.X转化为Y是放出能量 D.X转化为Z是吸收能量
难度: 简单查看答案及解析
-
下列有关反应限度的叙述正确的是
A.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B.依据焓判据:NH4HCO3受热分解可自发进行
C.大多数化学反应在一定条件下都有一定的限度
D.FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
难度: 中等查看答案及解析
-
反应

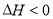 ,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开
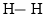 键的数目和生成
键的数目和生成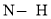 键的数目相等
键的数目相等D.容器内气体的浓度
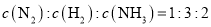
难度: 中等查看答案及解析
-
以铝-空气-海水为能源的电池为我国首创,该电池用于航海标志灯,只要把灯放入海水中数秒钟,就会发出耀眼的白光。电极材料为Al与石墨。该电池工作时,下列说法正确的是
A.铝电极是该电池的正极 B.海水中Cl-向石墨电极移动
C.石墨电极的反应:O2+2H2O+4e-=4OH- D.该新型电池属于二次电池
难度: 中等查看答案及解析
-
为减少雾霾天气,大容量的镍氢电池已经开始用于汽油/电动混合动力汽车上。镍氢电池放电时的电极反应为:H2+2OH--2e-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。下列说法正确的是
A.电池放电时,H2发生还原反应 B.电池放电时,Ni(OH)2发生氧化反应
C.电池充电时,H2O发生还原反应. D.电池充电时,NiO(OH)发生还原反应
难度: 简单查看答案及解析
-
超音速飞机可排放NO,这是平流层中氮的氧化物的主要来源,它破坏臭氧层的机理为:

 ;
;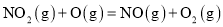
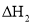 。总反应为:
。总反应为: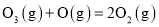
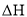 ,该反应的能量变化示意图如下:下列叙述中正确的是
,该反应的能量变化示意图如下:下列叙述中正确的是
A.
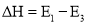
B.该反应是吸热反应
C.
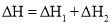
D.
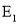 是反应
是反应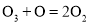 的活化能
的活化能难度: 中等查看答案及解析
-
已知汽车发动机工作时氮气与氧气转化为一氧化氮,能量变化关系如图所示,下列有关说法正确的是
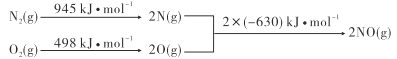
A.2NO(g)= N2(g)+O2(g)△H=+183kJ·mol-1
B.断裂1molN≡N键放出945kJ的能量
C.2molO(g)的总能量比1molO2(g)的多498kJ
D.N2(g)+O2(g)=2NO(g)的正反应活化能小于逆反应活化能
难度: 中等查看答案及解析
-
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)
 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=
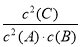
B.改变条件后,该反应的平衡常数K一定不变
C.如果改变压强并加入催化剂,平衡常数会随之变化
D.若平衡时增加A和B的浓度,则平衡常数会减小
难度: 中等查看答案及解析
-
对达到化学平衡的反应:2SO2(g)+O2(g)⇌2SO3(g),缩小体系体积,下列叙述中正确的是
A.活化分子的百分数增大,反应速率增大
B.单位体积内活化分子数增多,反应速率增大
C.正反应速率增大,逆反应速率减小,平衡正向移动
D.逆反应速率增大,正反应速率减小,平衡逆向移动
难度: 简单查看答案及解析
-
已知某锂电池的总反应为
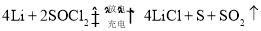 。下列说法错误的是
。下列说法错误的是A.金属锂是所有金属中比能量最高的电极材料
B.该电池组装时,必须在无水无氧条件下进行
C.放电时,电子从Li电极经电解质溶液流向正极
D.充电时,阳极反应式为
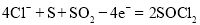
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )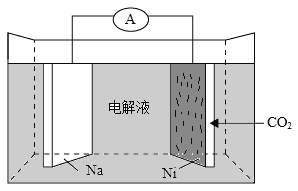
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
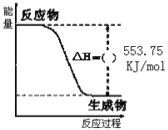
 O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。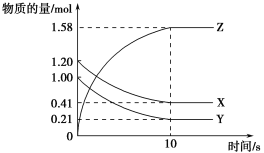
 2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。
2C(g)+3D(s),5 min达到平衡时,n(B):n(C) =1:3。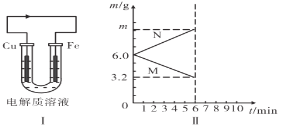
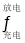 Ni(OH)2+M。在放电时正极的电极反应式为________。
Ni(OH)2+M。在放电时正极的电极反应式为________。