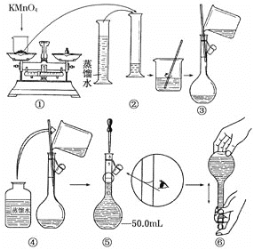
-
化学与材料、生活和环境密切相关。下列有关说法中正确的是( )
A. 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料
B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C. “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
D. 新型材料聚酯纤维、光导纤维都属于有机高分子化合物
难度: 简单查看答案及解析
-
下列说法正确的一组是( )
①不溶于水的盐都是弱电解质
②可溶于水的盐都是强电解质
③0.5 mol·L-1一元酸溶液中H+浓度为0.5 mol·L-1
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电
A.①③⑤⑥ B.只有④⑤ C.②④⑤⑥ D.只有③⑥
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol OD-和17 g —OH所含的质子与中子均为9NA
B.7.8 g Na2S与Na2O2的混合物,含离子总数为0.3NA
C.1 mol FeI2与足量氯气反应时转移的电子数为2NA
D.0.1 mol·L-1氯化铜溶液中氯离子数为0.2NA
难度: 中等查看答案及解析
-
纵观古今,化学与生活皆有着密切联系。下列说法错误的是( )
A.《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤…”。因为绿矾能电离出H+,所以有“味酸”.
B.《天工开物》记载:“凡白土曰垩土,为陶家精美器用”。陶是一种传统硅酸盐材料
C.“水声冰下咽,沙路雪中平”描述的是水的三态变化:“冰,水为之,而寒于水”,说明冰转化为水吸热
D.唐未《真元妙道要略)中有云:“以硫黄、雄黄合硝石并蜜烧之;焰起,烧手面及烬屋舍者”,文中描述的是黑火药的制作过程
难度: 中等查看答案及解析
-
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是( )
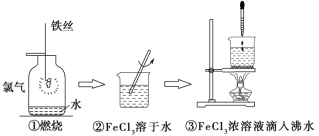
A.实验①、③反应制得的物质均为纯净物
B.实验②、③均未发生氧化还原反应
C.实验①、③均为放热反应
D.实验①、②所涉及的物质均为电解质
难度: 中等查看答案及解析
-
500 mL 2 mol·L-1FeCl3溶液和500 mL 2 mol·L-1明矾溶液分别滴入沸水中,加热制成分散系甲、乙,经测定,甲分散系中分散质的粒子直径大小在1~100 nm之间,乙分散系中分散质的粒子直径大小在10-9~10-7m之间。下列关于甲、乙分散系的判断合理的是( )
A.在暗室里用一束明亮的“强光”照射甲、乙,发现甲、乙均有丁达尔效应
B.向甲、乙中分别滴加过量的氢氧化钠溶液,现象都是“先聚沉,后溶解”
C.向甲、乙中分别滴加过量的氢碘酸,最终现象分别是深褐色溶液、白色沉淀
D.蒸干、灼烧FeCl3溶液和明矾溶液会得到对应的固体盐
难度: 中等查看答案及解析
-
下列用系统命名法命名有机物名称正确的是( )
A.2-甲基-4-乙基戊烷 B.2-羟基-3-甲基戊烷
C.2,3-二乙基-1-戊烯 D.1,2-二甲基-1-丁醇
难度: 中等查看答案及解析
-
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是 ( )
A.萃取是常用的有机物提纯方法
B.燃烧法是研究确定有机物成分的有效方法之一
C.核磁共振氢谱通常用于分析有机物的相对分子质量
D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中,能大量共存的是( )
①酸性溶液中:Fe2+、Al3+、
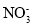 、Cl-、I-
、Cl-、I-②pH=13的溶液:Na+、
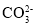 、
、 、
、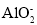 、S2-
、S2-③水电离出来的c(H+)=10-13 mol/L的溶液:
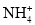 、K+、
、K+、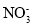 、
、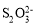
④加入铝片能放出H2的溶液:Na+、
 、Cu2+、
、Cu2+、
⑤滴加石蕊试液显红色的溶液:Fe3+、
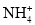 、Cl-、
、Cl-、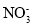
A.①② B.②③ C.②④⑤ D.②⑤
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.钠与水反应:Na + 2H2O = Na++ 2OH-+ H2↑
B.硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+= H2SiO3↓
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O
D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3-+ 6H+
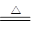 Fe3++ 3NO2↑ + 3H2O
Fe3++ 3NO2↑ + 3H2O难度: 中等查看答案及解析
-
含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6ClF3=6CoF3+3Cl2+4X。下列有关该反应的说法,正确的是( )
A.X与O3互为同位素
B.1 mol Co3O4在反应中转移9 mol电子
C.ClF3中氯元素为-3价
D.Co3O4在反应中作氧化剂
难度: 中等查看答案及解析
-
反兴奋剂是每届体育赛事关注的热点。利尿酸是一种常见的兴奋剂,其分子结构如下:
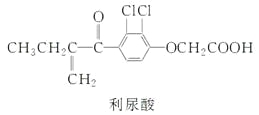
关于利尿酸的说法中,正确的是( )
A.它是芳香烃
B.它不能使酸性高锰酸钾溶液褪色
C.它不能与饱和碳酸钠溶液反应放出CO2
D.它能发生取代反应、加成反应和酯化反应
难度: 中等查看答案及解析
-
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项
操作及现象
结论
A
加入AgNO3溶液,生成白色沉淀,再加稀盐酸沉淀不溶解
原溶液中有Cl-存在
B
通入Cl2后,溶液变为深黄色,继续加入淀粉溶液后溶液变蓝
原溶液中有I-存在
C
加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时
原溶液中有
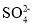 存在
存在D
加入稀盐酸,生成的气体能使澄清石灰水变浑浊
原溶液中有
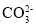 存在
存在A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法错误的是
A.利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
C.用过滤法无法除去Fe(OH)3胶体中的FeCl3
D.向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质
难度: 中等查看答案及解析
-
将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )
A.0.5 mol·L-1 B.3.0 mol·L-1 C.2.0 mol·L-1 D.1.0 mol·L-1
难度: 困难查看答案及解析
-
常温下,在pH=1的某溶液中可能有Na+、Fe3+、Fe2+、I-、Cl- 、
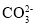 中的几种,现取100mL该溶液进行如下实验。根据实验结果,下列判断正确的是
中的几种,现取100mL该溶液进行如下实验。根据实验结果,下列判断正确的是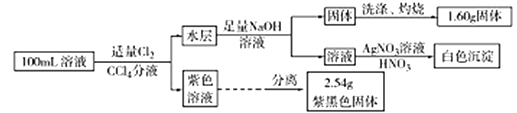
A.Fe2+、I-、Cl-三种离子一定存在
B.
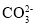 一定不存在,不能确定Na+和Cl-是否存在
一定不存在,不能确定Na+和Cl-是否存在C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl-)至少为0.2mol•L‑1
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A.在NH4Al(SO4)2溶液中滴加少量烧碱溶液:Al3++4OH-=
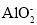 +2H2O
+2H2OB.在含等物质的量浓度的Na2CO3和NaOH溶液中滴加过量的盐酸:
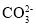 +OH-+2H+=
+OH-+2H+=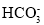 +H2O
+H2OC.在Mg(HCO3)2溶液中滴加过量的澄清石灰水:Mg2++2
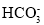 +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2OD.在Fe(NO3)2稀溶液中滴加少量NaHSO4溶液:Fe2++
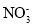 +2H+=Fe3++NO2↑+H2O
+2H+=Fe3++NO2↑+H2O难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.
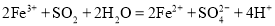
B.

C.
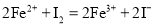
D.
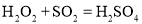
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是( )
选项
实验目的
实验操作
A
检验CH2=CHCH2OH中含有碳碳双键
向CH2=CHCH2OH中滴加酸性KMnO4溶液
B
区别植物油和矿物油
向植物油和矿物油中分别加入足量烧碱溶液,充分加热,冷却
C
制备乙酸乙酯
在试管中依次加入2 mL浓硫酸、3 mL乙醇和2 mL乙酸,用酒精灯缓慢加热
D
检验蔗糖的水解产物中是否含有葡萄糖
向蔗糖溶液中加入3~5滴稀硫酸,煮沸几分钟后,冷却,再向水解液中加入几滴银氨溶液,水浴加热
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某学生配制了100mL 1mol/L的硫酸溶液。然后,对溶液浓度做精确测定,且测定过程中一切操作都正确。结果测得溶液的物质的量浓度低于1mol/L.那么,在配制过程中,下列操作可能导致溶液浓度偏低的是( )
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切。
A.②③④ B.③④ C.①②③ D.①②③④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,4.48 L己烷含有的分子数为0.2NA
B.15 g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA
C.8.8 g乙酸乙酯中含共用电子对的数目为1.3NA
D.1 mol甲基(—14CD3)所含的中子数和电子数分别为11NA、10NA
难度: 中等查看答案及解析
-
某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+完全氧化。x值为( )
A.0.80 B.0.85 C.0.90 D.0.93
难度: 中等查看答案及解析
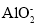 、
、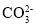 、
、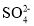 、I-、
、I-、 、
、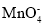 中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。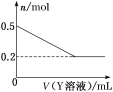
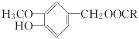 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图所示:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图所示: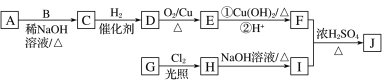

 。
。