-
化学在生活中有着广泛的应用,下列说法错误的是( )
A.Al2(SO4)3 和小苏打溶液反应可用于泡沫灭火器灭火
B.利用HF与SiO2反应,用氢氟酸在玻璃器皿上刻蚀标记
C.化石燃料完全燃烧不会造成大气污染
D.用浸泡过高锰酸钾溶液的硅藻土保存水果以达到保鲜的效果
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是( )
A.苯和聚乙烯均能发生加成反应
B.分子式为C5H10O2的有机物不一定能与NaHCO3溶液反应放出气体
C.两种不同的烷烃一定互为同系物
D.乙烷光照条件下能与溴水发生取代反应
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的是( )
实验目的
实验操作
A.
除去CO2中混有的HCl
将气体通过装有饱和碳酸钠溶液的洗气瓶
B.
由MgCl2溶液制备无水Mg Cl2
将MgCl2溶液加热蒸干
C.
证明Cu(OH)2的溶度积
比 Mg(OH)2的小
将0.lmol•L﹣1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.lmol•L﹣1CuSO4溶液
D.
苯萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
甲基环己烷的结构如图所示:
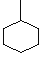 ,下列说法正确的是( )
,下列说法正确的是( )A.甲基环己烷的分子式为C7H16 B.甲基环己烷的一氯代物有4种
C.甲基环己烷中碳原子可能都处于同一平面 D.甲基环己烷与2﹣乙基一1一戊烯互为同分异构体
难度: 简单查看答案及解析
-
铅蓄电池是最常见的二次电池,电池总反应式为:Pb+PbO2+4H++2SO
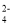
 2PbSO4+2H2O,下列说法错误的是( )
2PbSO4+2H2O,下列说法错误的是( )A.充电时,阴极反应式为:SO
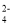 +4H++PbO2+2e﹣═PbSO4+2H2O
+4H++PbO2+2e﹣═PbSO4+2H2OB.充电时,两个电极的质量均减轻
C.电池放电时,电解质溶液的pH增大
D.电池放电时,负极可能会发生副反应:Pb+H2SO4═PbSO4+H2↑
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层有6个电子,B是迄今发现的非金属性最强的元素,在周期表中C位于IA族,D的氧化物为两性氧化物,E与A属于同一主族.下列说法正确的是( )
A.元素C、E的原子半径和简单离子半径均为:C>E
B.由C、E两种元素组成的化合物C2E2既含有离子键也含有共价键
C.最高价氧化物对应的水化物的碱性:D>C
D.常温下,由D单质制成的容器可盛装E的最高价氧化物的水化物的稀溶液
难度: 中等查看答案及解析
-
某酸H2A为二元弱酸.20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100mol•L﹣1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
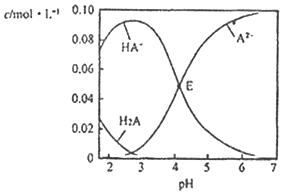
A.pH=2.5的溶液中:c(H2A)+c(A2﹣)>c(HA﹣)
B.c(Na+)=0.100moL•L﹣1的溶液中:c(H+)+c(H2A)=c(OH﹣)+c(A2﹣)
C.c(HA﹣)=c(A2﹣)的溶液中:c(Na+)>0.100mol•L﹣1+c(HA﹣)
D.pH=7.0的溶液中:c(Na+)<2c(A2﹣)
难度: 中等查看答案及解析
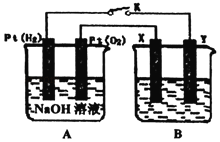
 )己成为环境修复研究的热点之一.Fe还原水体中NO
)己成为环境修复研究的热点之一.Fe还原水体中NO
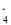 )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
) )>c(CO
)>c(CO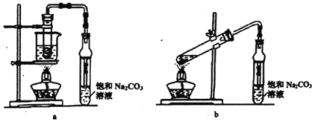
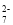 +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O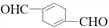 )的合成路线如下:
)的合成路线如下: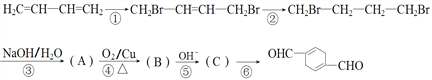
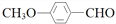 合成
合成 。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______
。(其他原料自选,用反应流程图表示,并注明必要的反应条件)。_______