-
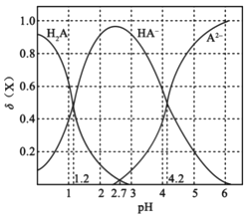
室温时,下列各溶液的叙述中正确的是
A. 将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀
B. 已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-) ]
C. 0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b
D. 0.10mol·L-1CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)
难度: 中等查看答案及解析
-
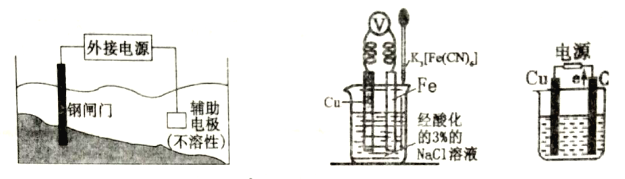
在测定中和热的实验中,下列说法正确的是
A. 使用环形玻璃棒是为了加快反应速率,减小实验误差
B. 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C. 用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积 相等,则测得的中和热数值相同
D. 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
难度: 中等查看答案及解析
-
金属(M)-空气电池的工作原理如图所示,下列说法不正确的是
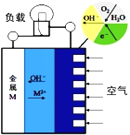
A. 金属M作电池负极
B. 电解质是熔融的MO
C. 正极的电极反应:O2+2H2O+4e-=4OH-
D. 电池反应:2M+O2+2H2O=2M(OH)2
难度: 简单查看答案及解析
-
用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是
A. 待加工铝制品为阳极
B. 可选用不锈钢网作为阴极
C. 阴极的电极反应式为:Al3++3e-=Al
D. 硫酸根离子在电解过程中向阳极移动
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. s电子绕核旋转,其轨道为一圆圈,而p电子是∞字形
B. 能层为1时,有自旋相反的两个轨道
C. 能层为3时,有3s、3p、3d、4f四个轨道
D. s电子云是球形对称的,其疏密程度表示电子在该处出现的几率大小
难度: 简单查看答案及解析
-
短周期元素中,原子基态时具有1个未成对电子的元素共有
A. 5 B. 6 C. 7 D. 8
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
难度: 中等查看答案及解析
-
对于反应;2NO(g)+2CO(g)
2CO2(g)+N2 (g) ΔH<0。若该反应在绝热恒容的密闭体系中进行,则下列示意图正确且能说明反应进行到t1 时已达到平衡状态的是
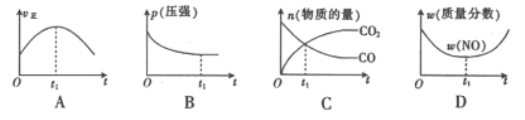
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
可逆反应A(?)+aB(g)
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
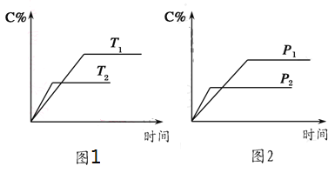
A.若a=2,则A为液态或固体
B.该反应的正反应为放热反应
C.T2>T1,p2>p1
D.其他条件不变,增加B的物质的量,平衡正向移动,平衡常数K增大
难度: 困难查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是( )
A. 水的离子积变大,pH变小,呈酸性
B. 水的离子积不变,pH不变,呈中性
C. 水的离子积变小,pH变大,呈碱性
D. 水的离子积变大,pH变小,呈中性
难度: 简单查看答案及解析
-
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A. H2Y电离方程式为:H2Y+H2O
HY-+H3O+
B. 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 常温下,酸式盐NaHY 的水溶液呈酸性
D. HY-的水解方程式为:HY-+ H2O
H3O++Y2-
难度: 中等查看答案及解析
-
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
难度: 简单查看答案及解析