-
部分弱酸的电离平衡常数如表:
弱酸
HCOOH
HCIO
H2CO3
H2SO3
电离平衡常(25℃)
Ka=1.77×10-4
Ka=4.0×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11
Ka1= 1.54×10-2
Ka2=1.02×10-7
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为______________。
(2)室温下①0.1mol·L-1 HCOONa,②0.1mol·L-1NaClO,③0.1mol·L-1Na2CO3,④0.1mol·L-1NaHCO3溶液的pH 由大到小的关系为_____________________________。
(3)下列离子方程式正确的是_______________ (填字母 ) 。
a.2ClO-+H2O+CO2=2HClO+CO32-
b.2HCOOH+ CO32-=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO32-
d.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)浓度均为0.1mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度由大到小的顺序为_________________________________。
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为_____________________________。
高二化学填空题困难题查看答案及解析
-
(Ⅰ)部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
H2CO3
H2SO3
电离平衡常数(25 ℃)
Ka=1.77
×10-4
Ka=4.0
×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为____________________。
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式______________。
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为__________________。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。

①该电解槽中通过阴离子交换膜的离子数_______(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 _____________;
③电解一段时间后,B出口与C出口产生气体的质量比为______________。
高二化学简答题困难题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
H2CO3
H2SO3
电离平衡常数(25 ℃)
Ka=1.77
×10-4
Ka=4.0
×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO
、CO
、HSO
、HCO
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
d.Cl2+H2O+2CO
=2HCO
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
高二化学填空题困难题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
H2CO3
H2SO3
电离平衡常数(25 ℃)
Ka=1.77×10-4
Ka=4.0×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11Ka1=1.54×10-2
Ka2=1.02×10-7(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1HCOONa,②0.1 mol·L-1NaClO,③0.1 mol·L-1Na2CO3,④0.1 mol·L-1NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO
、CO
、HSO
、HCO
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
d.Cl2+H2O+2CO
=2HCO
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
高二化学填空题困难题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
H2CO3
H2SO3
电离平衡常数
(25℃)
Ka=1.77×10-4
Ka=4.0×10-8
Ka1=4.3×10-7
Ka2=4.7×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列选项正确的是
A. 2ClO- + H2O + CO2 = 2HClO + CO32-
B. 2HCOOH + CO32- = 2HCOO- + H2O + CO2↑
C. H2SO3 + 2ClO- = 2HClO + SO32-
D. SO2(足量) + H2O+ CO32- = 2H2O + CO2+ SO32-
高二化学单选题困难题查看答案及解析
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________________。
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是___________;此时c(HCN)/c(CN-)=______________。
(3)已知CaCO3的Ksp=2.8×l0-9,现将浓度为5.6×l0-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为__________ mol/L。
高二化学综合题困难题查看答案及解析
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7 Ka2=5.6×10-11
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____。
③向NaCN溶液通入少量CO2反应的化学方程式是_______。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____,此时,
=_____。
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
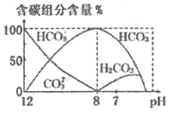
回答下列问题:
在同一溶液中H2CO3、
、
______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____,溶液中各种离子(
除外)的物质的量浓度的大小关系为______。
③已知在25℃时,
水解反应的平衡常数即水解常数Kh=
=2.0×10-4,当溶液中c(
):c(
)=2:1时,溶液pH=______。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________mol/L。
高二化学综合题中等难度题查看答案及解析
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数( 25℃)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________;
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
③向 NaCN溶液通入少量CO2反应的化学方程式是_______________________________;
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是________________;此时c(HCN)/c(CN-)=________________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是_____________________________。
(3)已知CaCO3的KSp=2.8×l0- 9,现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为____________mol/L。
高二化学填空题困难题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
高二化学单选题中等难度题查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
Ka=1.77×10-4
Ka=4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
高二化学单选题中等难度题查看答案及解析