-
某试剂瓶标签上安全标志如图,该试剂可能是

A.乙醇 B.烧碱 C.硝酸钾 D.明矾
难度: 简单查看答案及解析
-
化学与生活密切相关。下列叙述错误的是
A.NaClO溶液可用来杀灭新冠病毒
B.可用淀粉溶液来检验是否为加碘盐
C.制造医用口罩的材料聚丙烯来自于石油化工
D.葡萄酒可用二氧化硫作防腐剂和抗氧化剂
难度: 中等查看答案及解析
-
下到分析错误的是
A.酸性:HClO4>H3PO4 B.离子半径:F- >Mg2+
C.阴离子还原性:Cl->S2- D.H、N、O三种元素可形成离子化合物
难度: 中等查看答案及解析
-
下列离子在溶液中能大量共存的是
A.Na+、Ca2+、Cl-、CO
 B.HCO
B.HCO 、K+、NH
、K+、NH 、OH-
、OH-C.Fe2+、H+、SO
 、NO
、NO D.Na+、K+、CO
D.Na+、K+、CO 、SiO
、SiO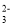
难度: 简单查看答案及解析
-
天然橡胶的单体是异戊二烯(
 ),下列说法正确的是
),下列说法正确的是A.与乙烯是同系物 B.能发生加成聚合反应
C.常温下能与水互溶 D.分子中所有原子共平面
难度: 简单查看答案及解析
-
下列反应的应用错误的是
A.可用氧化铁与铝在高温下反应炼铁 B.硫化钠与浓硫酸反应可制备硫化氢
C.铁丝在氯气中燃烧可制得无水三氯化铁 D.氧化钙与水反应可用作自热米饭加热
难度: 中等查看答案及解析
-
下列化学方程式中,不能准确表达其变化的是
A.钠在空气中变暗:2Na+O2 =Na2O2
B.蔗糖加浓硫酸变黑:C12H22O11
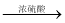 12C+11H2O
12C+11H2OC.漂白粉久置失效:Ca(ClO)2+CO2+H2O=CaCO3+ 2HC1O 2HC1O=2HCl+O2
D.SO2形成酸雨:2SO2+O2+2H2O=2H2SO4
难度: 简单查看答案及解析
-
下列有关物质的鉴别或检验错误的是
A.用激光笔照射区别食盐水和蛋白质溶液
B.向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+
C.将红色石蕊试纸伸到集气瓶口可检验瓶里是不是氨气
D.向溶液中滴入足量稀盐酸后再滴入氯化钡溶液,可检验溶液中是否存在SO

难度: 简单查看答案及解析
-
下列实验操作正确的是
A.配制0.4 mol/LNaOH溶液:将4.0 g NaOH固体放入250 mL容量瓶,加水至刻度线
B.除去乙酸乙酯中的少量乙酸:加入NaOH溶液洗涤、分液
C.测定氯水的pH:将氯水滴在pH试纸上,然后与标准比色卡比较
D.验证Mg(OH)2的溶解度比Fe(OH)3大:向Mg(OH)2悬浊液中滴入FeCl3溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A.升高H2SO4稀溶液温度,溶液中c(OH-)增大
B.pH=3的CH3COOH溶液加入CH3COONa固体,溶液的pH减小
C.NaClO稀溶液中加入NaClO固体,溶液中
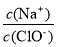 增大
增大D.向AgCl、Ag2CrO4的饱和溶液中加入少量AgNO3固体,溶液中
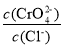 不变
不变难度: 困难查看答案及解析
-
下列实验现象和结论均正确的是
A.将石蜡油蒸气通过炽热碎瓷片后产生的气体通入酸性KMnO4溶液,溶液紫色褪去,说明气体中不含烷烃
B.将铝箔在酒精灯上加热,熔化的铝不滴落,说明氧化铝的熔点比铝高
C.将钠投入盛有无水乙醇的试管中,钠浮在液面上且有气泡冒出,说明钠密度比乙醇小
D.将少量过氧化钠粉末加入水中,向反应后的溶液中滴入酚酞溶液,溶液保持红色,说明反应生成了碱
难度: 中等查看答案及解析
-
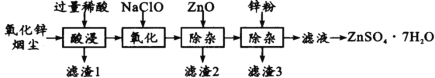
实验室探究从海水中提取溴的主要过程为:
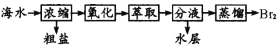 ,
,下列装置或操作在实验中未涉及到的是
A.
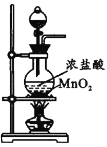 B.
B.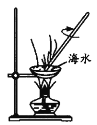
C.
 D.
D.
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值。下列说法错误的是
A.1 L 0.1 mol/L NH4 NO3溶液中含有氮原子总数为0.2 NA
B.7.8 g Na2 O2与水完全反应,转移的电子数为0.2 NA
C.2.8 g CO和N2混合气体中含有质子数为1.4 NA
D.标准状况下,2. 24 L环丙烷中化学键数目为0.9 NA
难度: 中等查看答案及解析
-
为达到相应实验目的,下列实验设计可行的是
编号
实验目的
实验过程
A
探究浓度对化学平衡移动的影响
向盛有5 mL 0.1 mol/L K2 Cr2 O7溶液的试管中滴入3滴浓硫酸,振荡
B
观察Fe(OH)2颜色
向盛有FeSO4溶液的试管中滴入氨水,立即振荡
C
检验K+
用玻璃棒蘸取待测液在无色火焰上灼烧,观察现象
D
探究浓度对反应速率的影响
向2支盛有2 mL 0.0 l mol/L H2C2O4溶液的试管中分别加入4 mL 0.0 l mol/L和 0.02 mol/L KMnO4溶液,观察现象
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
实验室利用下图所示装置测定水中氢氧元素之比。下列说法错误的是
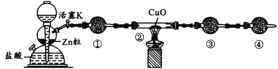
A.①、③、④中依次盛装无水CaCl2、碱石灰、碱石灰
B.需测定实验前后装置②和装置③的质量差
C.结束反应时,应先移走酒精灯,待装置②的玻璃管冷至室温,再关闭活塞K
D.实验后装置②的玻璃管中CuO未全部变红,对实验结果无影响
难度: 困难查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
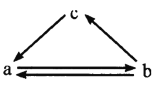
选项物质
a
b
c
A
Na2 CO3
NaHCO3
CO2
B
NO
NO2
HNO3
C
FeCl3
FeCl2
Fe
D
Al2O3
Al(OH)3
AlCl3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
锂可用于氮的固定,其转化过程如图所示。下列说法错误的是
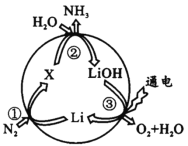
A.反应①中N2是氧化剂
B.反应②属于复分解反应
C.转化过程中涉及的H2O、LiOH都属于电解质
D.反应③中Li在阳极生成
难度: 中等查看答案及解析
-
液体锌二次电池具有电压高、成本低、安全性强和可循环使用等特点。已知:①Zn(OH)2+2OH-=Zn(OH)
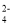 ;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是
;②KOH凝胶中允许离子存在、生成或迁移。下列说法错误的是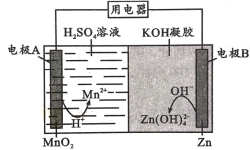
A.电池放电时,电子由电极B经导线流向电极A
B.电池反应为MnO2+ Zn + 4H++4OH-=Mn2+ + Zn(OH)
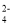 +2 H2 O
+2 H2 OC.电池充电时,H+向电极A移动
D.电池充电时,电极B的质量增大
难度: 中等查看答案及解析
-
用活性炭还原氮氧化物可防止空气污染。向1L密闭容器加入一定量的活性炭和NO,某温度下发生反应:
已知:①C(s)+2NO(g)
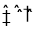 N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH②C(s)+O2(g)
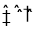 CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol③N2(g)+O2(g)
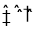 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol下列说法错误的是
A.ΔH= -574.0 kJ/mol
B.当容器内气体密度不变时,反应①达到平衡状态
C.反应③正反应的活化能大于180.5 kJ/mol
D.反应①达到平衡后,增大压强平衡向正反应方向移动
难度: 中等查看答案及解析
-
室温下,用0.10mol/L CH3 COOH溶液滴定10.00mL浓度均为0.10 mol/L NaOH和NH3·H2O的混合液,混合溶液的相对导电能力随乙酸滴入的变化曲线如下图所示。已知:Ka(CH3COOH)=1. 8×10-5,Kb( NH3·H2O) =1. 8× l0-5。下列叙述错误的是
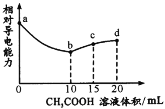
A.ab段为CH3COOH与NaOH的中和过程
B.b点水的电离程度最大
C.c点3c(Na+)=2c(CH3 COOH)+2c(CH3 COO-)
D.d点c(Na+)>c(NH
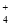 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)难度: 困难查看答案及解析
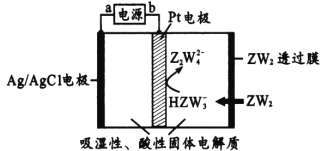
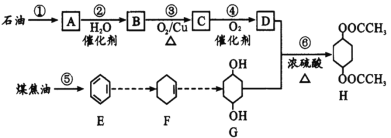
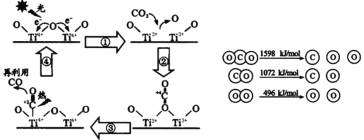
 ,则正极的反应式为___;电路中转移1 mol电子,需消耗CO2_____L(标准状况)。
,则正极的反应式为___;电路中转移1 mol电子,需消耗CO2_____L(标准状况)。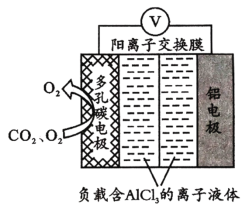
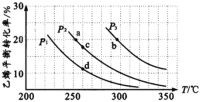
 C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。