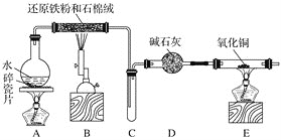
-
将含有等体积NH3、CO2、NO的混合气体依次通过盛有浓H2SO4、Na2O2和NaHCO3溶液的装置,充分作用后,最后得到的气体是( )
A. CO2和NO B. CO2 C. NO D. NO2
-
高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2F(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
A. 制高铁酸钾用KClO做还原剂
B. KCl是还原产物
C. 高铁酸钾中铁的化合价为+7
D. 制备高铁酸钾时1molFe (OH)3得到3 mol电子
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入到过量NaHCO3溶液中 ④向NaAlO2溶液中滴入少量盐酸 ⑤向饱和Na2CO3溶液中通入足量CO2
A. ①③④⑤ B. 只有①④ C. 只有②③ D. 只有③④⑤
-
关于0.1 mol·L-1硫酸溶液的叙述错误的是( )
A. 1 L该溶液中含有硫酸的质量为9.8 g
B. 0.5 L该溶液中氢离子的物质的量浓度为0.2 mol·L-1
C. 从1 L该溶液中取出100 mL,则取出溶液中硫酸的物质的量浓度为0.01 mol·L-1
D. 取该溶液10 mL,加水稀释至100 mL后硫酸的物质的量浓度为0.01 mol·L-1
-
下列说法中不正确的是
A. 碳酸钠比碳酸氢钠易溶于水
B. 碳酸钠比碳酸氢钠稳定
C. 碳酸钠和碳酸氢钠能跟石灰水反应得到白色沉淀
D. 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应,得到相同质量的二氧化碳
-
用等质量的金属钠进行下列实验,产生氢气最多的是( )
A. 将钠放入足量的稀盐酸中
B. 将钠放入足量的稀硫酸中
C. 将钠放入足量的氯化钠溶液中
D. 将钠用铝箔包好,并刺一些小孔,放入足量的水中
-
下列做法正确的是
A. 用镊子取出白磷并置于水中切割
B. 把氯酸钾制氧气后的残渣倒入垃圾桶
C. 氢气还原氧化铜实验先加热再通氢气
D. 用酒精灯直接给烧杯中的液体加热
-
把下列金属投入0.1 mol·L-1盐酸中,能发生反应且反应最剧烈的是( )
A. Cu B. Fe C. Mg D. Al
-
关于氨的喷泉实验形成的原理解释正确的是
A. 氨水呈碱性 B. 氨气极易溶于水,烧瓶内外形成压强差
C. 氨气易液化 D. 氨气溶于水后形成的溶液易挥发
-
用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.标准状况下,6.72L O2和N2的混合气体含有的原子数为0.6NA
B.通常状况下,8g O2和O3 的混合气体含有的分子数是0.5NA
C.常温常压下, 2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA
D.标准状况下,11.2L H2在氧气中完全燃烧后得到的产物的分子数为0.5NA
-
下列反应不能一步完成的是( )
A. SiO2―→Na2SiO3 B. SiO2―→H2SiO3
C. SiO2―→CaSiO3 D. H2SiO3―→SiO2
-
下列图示的四种实验操作名称从左到右依次是
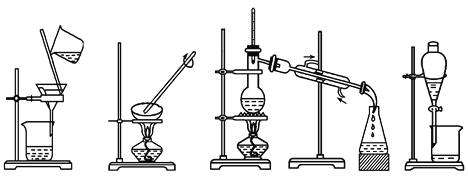
A. 过滤、蒸发、蒸馏、分液 B. 过滤、蒸馏、蒸发、分液
C. 蒸发、蒸馏、过滤、分液 D. 分液、蒸馏、蒸发、过滤
-
瓦斯中甲烷与氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比为
A. 1:2 B. 1:4 C. 2:1 D. 1:1
-
飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为2NH4ClO4===N2↑+Cl2↑+2O2↑+4H2O。下列有关叙述不正确的是( )
A. 该反应属于分解反应、氧化还原反应
B. 上述反应瞬间能产生大量高温气体,推动飞船飞行
C. 铝粉的作用是点燃时氧化放热引发高氯酸铵反应
D. 在反应中NH4ClO4只作氧化剂
-
小王要制备纯净的二氧化碳气体,可供选用的仪器如图所示。可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水。下列装置连接顺序及组合最恰当的是( )
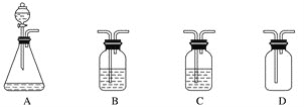
A. A(①⑤)、B(④)、C(⑦)、D B. A(①③)、B(④)、C(⑦)、D
C. A(①⑤)、B(⑦)、C(④)、D D. A(①⑤)、B(⑥)、C(④)、D
-
将质量分数为a%,物质的量浓度为c1mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数 变为2a%,此时该H2SO4的物质的量浓度为c2mol·L-1,则c1和c2的数值关系是
A. c2=2c1 B. c2>2c1 C. c2<2c1 D. 无法确定
-
对下列实验过程的评价,正确的是
A. 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
B. 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
C. 验证烧碱溶液中是否含Cl-,先加稀硝酸除去OH-,再加AgNO3溶液,有白色沉淀,证明含Cl-
D. 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42-
-
下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
A. Na+ Ca2+ SO42- Cl- B. H+ Mg2+ CO32- S2-
C. K+ Mg2+ SO42- NO3- D. K+ Na+ NO3- SO42-
-
符合如图中阴影部分的物质是( )
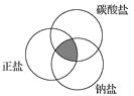
A. 碳酸氢钠 B. 碱式碳酸铜
C. 氯化钠 D. 碳酸钠
-
氯气、液氯、氯水、盐酸中均含有( )
A. 氯分子 B. 氯原子 C. 氯离子 D. 氯元素
-
下列变化不可能通过一步实验直接完成的是( )
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
-
将0.3 mol钠、0.1 mol铁分别加入到各盛有500 mL 0.2 mol·L-1稀硫酸的两个烧杯中,下列说法正确的是( )
A. 两个烧杯中金属沉在液面下
B. 两个烧杯中都没有金属剩余
C. 两个烧杯中都有金属剩余
D. 两个烧杯中产生氢气的质量相同
-
化学与环境密切相关,下列有关说法正确的是
A. CO2属于大气污染物
B. 酸雨是pH小于7的雨水
C. CO2、NO2或SO2都会导致酸雨的形成
D. 大气中CO2含量的增加会导致温室效应加剧
-
已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示。则下列关于C的性质的叙述错误的是( )
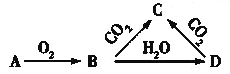
A. 易溶于水
B. 与澄清石灰水反应产生白色沉淀
C. 与足量盐酸反应放出气体
D. 属于碱
-
将硫磺在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入Na2S产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素。在下列各组中按A、B、C、D、E排列的是( )
A.SO2、H2SO4、H2SO3、H2S、S B.SO2、H2SO3、H2SO4、SO2、SO3
C.SO2、H2SO4、H2SO3、SO2、S D.SO2、H2SO3、H2SO4、H2S、S
-
下列关于氨水的叙述中,不正确的是( )
A. 氨水具有弱碱性 B. 氨水和液氨成分相同
C. 氨水中共有6种粒子 D. 氨水中一水合氨的物质的量浓度最大(除水外)
-
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的 水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的不可能是 ( )
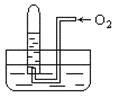
A. N2与NO2的混和气体 B. O2与NO2的混和气体
C. NO与NO2的混和气体 D. NO2一种气体



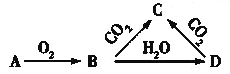

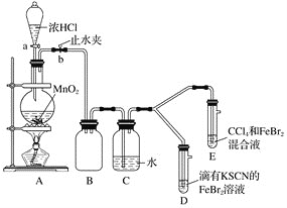
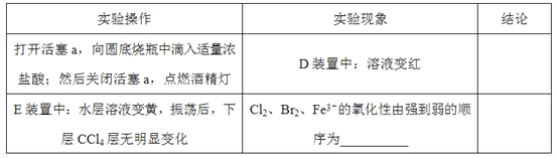
 Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。