-
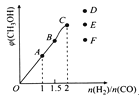
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A. 1∶7 B. 1∶9 C. 1∶5 D. 2∶9
难度: 中等查看答案及解析
-
W、Q、X、Y、Z是五种短周期主族元素,其中X原子K、L层电子数之比为1∶2,Y元素最外层电子数是次外层的3倍,Z是短周期主族元素中原子半径最大的元素,W是地壳中含量最高的金属元素, Q元素最高化合价与最低化合价之和为6。下列判断正确的是
A. W、Q、X、Y、Z的原子序数依次递增
B. Y的简单氢化物比X的稳定性高
C. 常温下,W元素的单质与浓硝酸反应生成NO2
D. Z、W的单质分别与Q的单质化合后的产物中所含化学键类型相同
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能溶解Al2O3的溶液中:Na+、Fe2+、ClO-、SO42-
B. 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C. 含有Na2SO3的溶液中:K+、H+、Cl-、NO3-
D. 由水电离产生的c(OH-)=l×10-10mol·L-1的溶液中:Ba2+、K+、NO3-、Br-
难度: 中等查看答案及解析
-
下列有关说法错误的是
A. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
B. 向雨水中加入少量硫酸铁溶液会使浑浊的雨水变澄清
C. 节日燃放的烟花,是碱金属、锶、钡、铁等金属元素焰色反应呈现的
D. 用K2FeO4代替Cl2处理饮用水,既能杀菌消毒又能净水
难度: 简单查看答案及解析
-
已知2SO2(g)+O2(g)
 2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是
2SO3(g)△H =-198kJ·mol-1。400℃,1.01×105Pa,向容积为2L 的恒容密闭容器中充入一定量SO2和O2,n(SO3)和n(O2)等随时间的变化曲线如图所示。下列叙述正确的是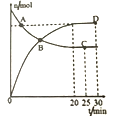
A. A点v 正(SO2) >v 逆(SO3) B. B点表示反应处于平衡状态
C. D点n(SO2)大于C点 D. 其它条件不变,升温至500℃并达平衡时,n(SO3)比图中D 点的值大
难度: 中等查看答案及解析
-
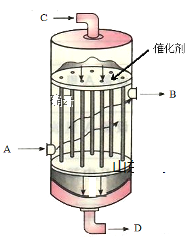
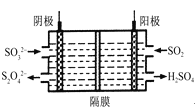
用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2 制备金属钛。下列说法正确的是
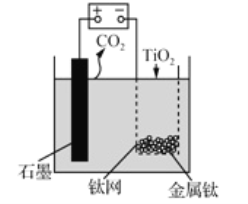
A. 电解过程中,Ca2+ 向阳极移动
B. 阳极的电极反应式为: C+ 2O2--4e-=CO2 ↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接Pb 电极
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 用灼烧的方法鉴别羊毛线和棉线
B. 做银镜反应实验后,试管壁上的银镜用稀硝酸清洗
C. 沾附在试管内壁上的油脂,用热碱液洗涤
D. 分馏石油时,温度计的水银球必须插入液面以下
难度: 简单查看答案及解析
-
锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A. 电池工作时,锌失去电子,电解液内部OH﹣向负极移动
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣═Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
已知阿伏加德罗常数的值为NA。下列说法正确的是
A. 28gN2与足量氢气反应,转移电子的数目为6NA
B. 11.2LHF含有的分子数为0.5NA
C. 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA
D. 向FeI2溶液中通入一定量Cl2,当1molFe2+被氧化时,转移的电子数不小于3NA
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B. 向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
C. 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
D. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
难度: 困难查看答案及解析
-
利用下列实验装置能达到实验目的的是
A. 除去乙烯中少量的SO2
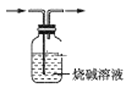
B. 制备纯净的氯气
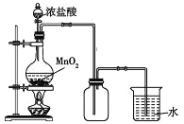
C. 称量10.05g食盐

D. 探究氯、碳、硅的非金属性强弱
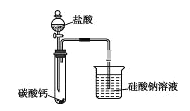
难度: 中等查看答案及解析
-
用如图所示装置进行锌与稀硫酸反应速率的测定。下列说法错误的是( )
甲装置:
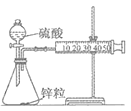 乙装置:
乙装置: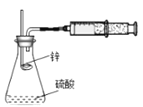
A. 将甲装置分液漏斗旋塞打开,分液漏斗里的液体顺利流下,并不能说明整套装置气密性不好
B. 需要测量单位时间内产生气体的体积或产生一定体积的气体需要的时间
C. 甲装置因为逐滴加入硫酸,硫酸的体积和浓度的变化会造成误差,用乙装置可以减小该误差(乙装置中燃烧匙可上下移动)
D. 只需要将甲装置中锌粒改为铜片,稀硫酸改为浓硫酸,就可以用此装置测定铜与浓硫酸的反应速率
难度: 中等查看答案及解析
-
下列实验操作或事实与预期实验目的或所得结论对应正确的是
选项
实验操作或事实
实验目的或结论
A
淡黄色试液
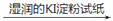 溶液变蓝色
溶液变蓝色说明原溶液中一定含有Fe3+
B
向AgNO3溶液中滴加过量氨水,溶液澄清
Ag+与NH3∙H2O能大量共存
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝
NH4HCO3显碱性
D
H3PO3+2NaOH(足量)=Na2HPO3+2H2O
H3PO3属于二元酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.下列说法中不正确的是
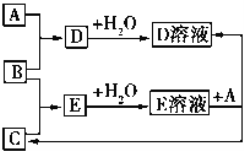
A. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B. A、B、C中三种元素形成的化合物所属物质类别一定不是碱
C. 如果E溶液是一种强酸,则E溶液为盐酸
D. A、B、C中有一种金属且为A
难度: 困难查看答案及解析
-
在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应:2CO(g)+SO2(g)
 S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。容器
起始时物质的量/mol
平衡时CO2(g)的物质的量/mol
CO(g)
SO2(g)
S(g)
CO2(g)
甲
1
0.5
0.5
0
a
乙
1
0.5
0
0
0.8
丙
2
1
0
0
b
下列说法正确的是
A. 其他条件不变,容器乙达到平衡后,再充入体系中四种气体各1mol,平衡逆向移动
B. b=1.6
C. 平衡常数:K甲>K乙
D. 其他条件不变,向容器甲再充入1mol CO,平衡常数(K)不变
难度: 困难查看答案及解析
-
pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
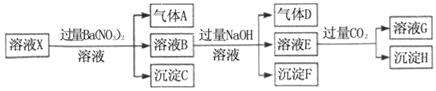
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L﹣1
难度: 困难查看答案及解析
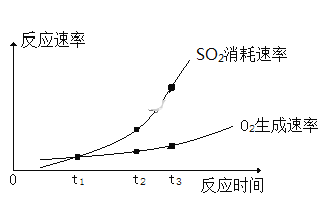
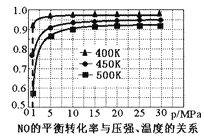
 2SO3(g) △H=-196kJ/mol
2SO3(g) △H=-196kJ/mol