-
下列物质的性质和用途不存在因果关系的是
A.小苏打受热易分解,在面粉中加入适量小苏打焙制糕点
B.醋酸酸性强于碳酸,用醋酸溶液清除热水器中的水垢
C.胶体具有电泳的性质,可向豆浆中加入盐卤制作豆腐
D.氧化铝熔点高,可作耐高温材料
难度: 中等查看答案及解析
-
芳樟醇(
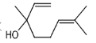 )是常用的香料,下列有关芳樟醇说法正确的是
)是常用的香料,下列有关芳樟醇说法正确的是A.能使酸性高锰酸钾溶液和溴水均褪色的原理不同 B.分子中所有碳原子共平面
C.与溴的 CCl4 溶液不反应 D.与有机物
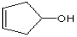 互为同系物
互为同系物难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.l mol C2H6O 分子中含 C-H 键数目为 0.5 NA
B.1 mol·L-1 的 NH4Cl 溶液中含有
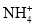 数目小于 0.1 NA
数目小于 0.1 NAC.25℃时,1 L pH=13 的 Ba(OH)2 溶液中含有 OH-的数目为 0.2NA
D.1 mol Cl2 与足量铜铁合金反应,转移电子数一定是 2 NA
难度: 中等查看答案及解析
-
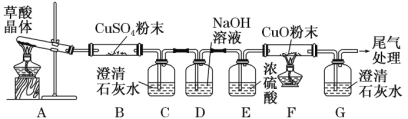
有关下列四组实验描述不正确的是
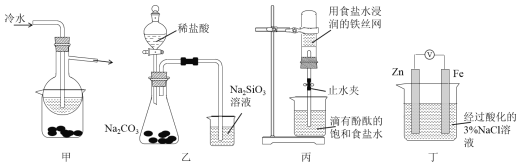
A.加热甲装置中的烧杯可以分离SiO2和NH4Cl
B.利用装置乙可证明非金属性强弱:Cl>C>Si
C.打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D.向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
难度: 困难查看答案及解析
-
Q、X、Y、Z 为短周期元素,它们在周期表中的位置如图所示。这 4 种元素的原子最外 层电子数之和为 22。下列说法错误的是
X
Y
Q
Z
A.X、Y 和氢 3 种元素形成的化合物中可能含有离子键
B.X、Y 的简单离子电子层结构相同,且简单离子半径:X<Y
C.Z 的最高价氧化物对应的水化物是一种强酸
D.简单气态氢化物的稳定性:Q<Z
难度: 简单查看答案及解析
-
摩拜单车可利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,锂离子电池反应原理为 Li1-xCoO2+LixC6
 LiCoO2+6C,装置示意图如图所示。下列说法错误的是
LiCoO2+6C,装置示意图如图所示。下列说法错误的是
A.充电时,阴极质量增加,发生还原反应
B.充电时,电路中每有 1 mol 电子通过,则有 1 mol Li+通过聚合物电解质膜
C.该锂离子电池放电时,化学能转化为电能
D.放电时,正极的电极反应式为 LiCoO2-xe-=Li1-xCoO2+xLi+
难度: 中等查看答案及解析
-
常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是

A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2O⇌HX-+OH-的平衡常数对数值1gK=-11
难度: 中等查看答案及解析
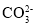 =
=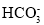 +
+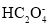 B.
B.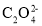
 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。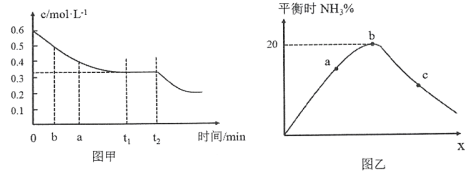
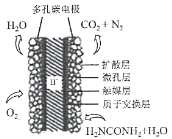


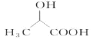 )的合成路线(其他无机试剂任选)______。
)的合成路线(其他无机试剂任选)______。