-
诗词话科学——对下列诗句所描述现象的解释.你认为错误的是
选项
成语或诗句
用化学知识解释
A
宋●赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”
描述了金属元素焰色反应的现象
B
南北朝●庾信诗句“独忆飞絮鹅毛下.非复青丝马尾垂”
这里的"飞絮”与“马尾”化学 成分分别是纤维素和蛋白质
C
明●于谦诗句“粉身碎骨浑不怕”
它指石灰石碾碎成粉末状的物理变化过程
D
宋●苏轼诗句“投泥泼水愈光明”
指高温下把水滴到炭火上,得到两种可燃性气体
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
根据化学反应的实质是旧键断裂和新键形成这一观点,下列不属于化学变化的是
A.食品变质 B.胆矾晶体受热由蓝色变白色
C.在稀盐酸中滴入紫色石蕊试液,溶液变红 D.石油分馏
难度: 中等查看答案及解析
-
有关煤和石油的叙述中正确的是
A.煤中含有苯、甲苯、二甲苯等芳香烃,通过煤的干馏可以获得
B.煤的液化是化学变化,煤的气化为物理变化
C.石油中含有大量的烃,石油是多种烃的主要来源
D.通过石油分馏得到的汽油、煤油均是纯净物
难度: 简单查看答案及解析
-
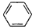
下列化学用语表示不正确的是
A.苯的结构简式:
 B.NaCl的电子式:
B.NaCl的电子式: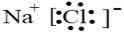
C.Mg2+的结构示意图:
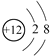 D.氯化钙的电离方程式:CaCl2=Ca2++Cl2
D.氯化钙的电离方程式:CaCl2=Ca2++Cl2难度: 中等查看答案及解析
-
某同学设计了探究影响反应速率因素的如下两组实验,该同学探究的影响因素是
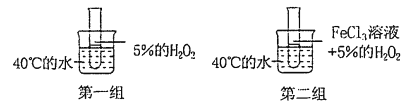
A.浓度 B.压强 C.温度 D.催化剂
难度: 简单查看答案及解析
-
上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法正确的是
A.NO是酸性氧化物,它与水反应生成亚硝酸(HNO2)
B.NO是造成光化学烟雾的因素之一
C.因为NO在人体内起着多方面的重要生理作用,所以NO对人类无害
D.NO分子所含电子总数为偶数
难度: 简单查看答案及解析
-
下列说法不正确的是
A.正己烷和2,2-二甲基丙烷互为同系物 B.18O2和16O2互为同位素
C.N2和N4互为同素异形体 D.H2NCOOCH3和CH3CH2NO2互为同分异构体
难度: 简单查看答案及解析
-
将铜纳米颗粒和银纳米颗粒相隔一定距离固定在石墨片上,然后浸在AgNO3溶液中,可构成一种纳米型原电池。该电池负极发生的反应为( )
A.Ag++e—===Ag
B.Cu-2e—===Cu2+
C.Cu2++2e—===Cu
D.2H++2e—===H2↑
难度: 简单查看答案及解析
-
下列实验能达到实验目的且符合安全要求的是
A.
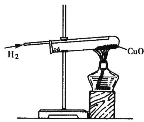 B.
B.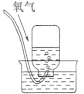 C.
C.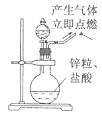 D.
D.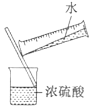
难度: 中等查看答案及解析
-
下列物质不能通过化合反应生成的是
A.FeCl3 B.Al(OH)3 C.Fe(OH)3 D.Cu2(OH)2CO3
难度: 简单查看答案及解析
-
在一定温度下,向密闭容器中充入一定量的NO2和SO2,发生反应:NO2+SO2
 NO+SO3,当化学反应达到平衡时,下列叙述正确的是( )。
NO+SO3,当化学反应达到平衡时,下列叙述正确的是( )。A.SO2和SO3的物质的量一定相等
B.NO2和SO3的物质的量一定相等
C.反应混合物的总物质的量一定等于反应开始时NO2和SO2的总物质的量
D.SO2、NO2、NO、SO3的物质的量一定相等
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A.向NaOH溶液中加入铝粉来制备H2:Al+2OH- +2H2O= AlO
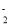 +3H2↑
+3H2↑B.用胃舒平[主要成分为Al(OH)3]治疗胃酸过多:Al(OH)3+3H+=Al3+ +3H2O
C.酸性高锰酸钾溶液吸收二氧化硫:5SO2 +4H++2MnO
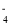 =2Mn2+ +5SO
=2Mn2+ +5SO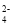 +2H2O
+2H2OD.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu.
难度: 中等查看答案及解析
-
下列说法正确的是
A.同一原子中,在离核较远的区域运动的电子能量较高
B.原子核外电子排布,先排满K层再排L层、先排满M层再排N层
C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大
D.同一周期中,IIA与IIIA族元素原子的核电荷数都相差1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1 mol CH2=CH2分子中含有的共用电子对数为6NA
B.500mL0.5mol·L-1的NaCl溶液中微粒数大于0.5NA
C.30gHCHO与CH3COOH混合物中含C原子数为NA
D.2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为16。Y的单质是空气中含量最多的气体,Z原子的最外层电子数是其内层电子数的3倍,W是短周期中金属性最强的元素。下列说法正确的是
A.X位于元素周期表中第2周期VA族
B.原子半径:r(X)>r(Y)>r(Z)>r(W)
C.X、Y、Z的非金属性依次减弱
D.由Z和W组成的化合物W2Z和W2Z2中阴阳离子个数比均为1:2
难度: 中等查看答案及解析
-
一定温度下,在2 L的恒容密闭容器中发生反应
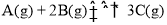 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:n/mol
t/min
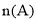
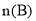
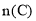
0
2.0
2.4
0
5
0.9
10
1.6
15
1.6
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为
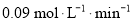
B.该反应在10 min后才达到平衡
C.平衡状态时,
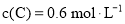
D.物质B的平衡转化率为20%
难度: 中等查看答案及解析
-
铬可用于制造不锈钢、汽车零件、工具、磁带和录像带等。铬的金属性位于锌和铁之间,根据元素周期律的知识,下列有关铬的性质说法不正确的是( )
A.铬与冷水能发生剧烈反应 B.Cr(OH)3的碱性比NaOH的弱
C.高温条件下,Al能与Cr2O3反应置换出Cr D.铬能与稀盐酸发生反应
难度: 中等查看答案及解析
-
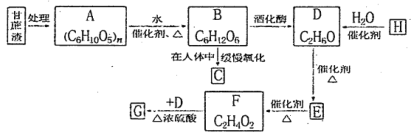
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述正确的是
A.食物中的营养物质都能为人的生命活动提供能量
B.淀粉和纤维素
 葡萄糖
葡萄糖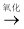 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)C.油脂
 甘油和高级脂肪酸
甘油和高级脂肪酸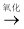 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)D.人体必需的微量元素实际上就是维生素
难度: 中等查看答案及解析
-
在某温度时将2molA和1molB两种气体通入容积为2L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)
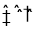 xC(g),2min时反应测的B的物质的量为0.4mol,C在前2 min内的平均反应速率为0.45 mol·L-1·min-1。下列各项能表明该反应达到平衡的是
xC(g),2min时反应测的B的物质的量为0.4mol,C在前2 min内的平均反应速率为0.45 mol·L-1·min-1。下列各项能表明该反应达到平衡的是A.vA(正) : vB(逆)=2:1 B.混合气体密度不再变化
C.混合气体压强不再变化 D.混合气体的相对分子质量不再改变
难度: 中等查看答案及解析
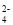 (aq)=BaSO4(s) △H=-13.4kJ/mol
(aq)=BaSO4(s) △H=-13.4kJ/mol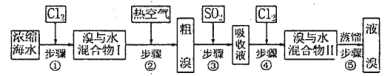

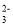 +6H2O。则下列说法正确的是____(填序号)。
+6H2O。则下列说法正确的是____(填序号)。