-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)= K2S(s)+ N2(g)+3CO2 (g) ΔH =x kJ·mol-1
已知:碳的燃烧热ΔH1=a kJ·mol-1;
S(s)+2K(s)=K2S(s) △H2=b kJ·mol-1
2K(s)+N2 (g)+3O2(g)=2KNO3(s) △H3= c kJ·mol-1;则x为( )
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
难度: 简单查看答案及解析
-
下列有关化学用语的表示方法中不正确的是
A.18O在周期表中的位置是第二周期第VIA族
B.Na+的结构示意图:

C.R2+离子核外有a个电子,b个中子,R原子符号为

D.次氯酸的电子式:
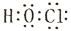
难度: 简单查看答案及解析
-
下列各物质或微粒性质的比较中正确的是
A.离子半径: K+>O2->Al3+>S2->Cl- B.离于的还原性: S2->Cl->Br->I-
C.酸性: HClO>H2SO4>H3PO4>H2SiO3 D.非金属性: F>O>S
难度: 中等查看答案及解析
-
下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.b、c的最高价氧化物对应水化物可以反应
D.a和b形成的化合物不可能含共价键
难度: 困难查看答案及解析
-
下列叙述不正确的是
①离子化合物中一定有离子键,可能有共价键
②熔点: Al>Na>K
③第IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从Ⅲ B族到II B族10个纵行的元素都是金属元素
⑤沸点: NH3<PH3<AsH3
⑥NaCl和HCl溶于水破坏相同的作用力
⑦因为常温下白磷可燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
A.②④⑥ B.③⑤⑥⑦ C.②④⑥⑦ D.⑤⑥⑦
难度: 中等查看答案及解析
-
下列数据或事实所呈现的规律不能用元素周期律解释的是
A.
 B.
B.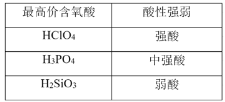
C.
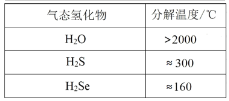 D.
D.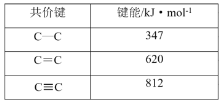
难度: 中等查看答案及解析
-
主族元素Q、R、X、Y、Z的原子序数依次增大,且不超过20,Q原子最外层电子数是内层电子数的2倍,R、X、Y均在同一周期,R最外层电子数与最内层电子数相等,Z与R为同一主族,X的单质在空气中燃烧所得产物能使品红褪色。则下列说法正确的是( )
A.原子半径大小的顺序:r(R)>r(X)>r(Y)>r(Z)
B.Q元素在自然界中只存在一种单质
C.R的最高价氧化物对应水化物的碱性比Z的弱
D.元素X的简单氢化物的热稳定性比Y的强
难度: 中等查看答案及解析
-
利用海水提取溴和镁的过程如下,下列说法不正确的是( )

A.若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2
B.工业上常利用电解熔融MgCl2冶炼金属镁
C.富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D.工业溴中含少量Cl2,可用NaOH溶液除去
难度: 中等查看答案及解析
-
下列属于氧化还原反应且热量变化与下图一致的是
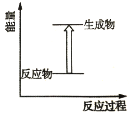
A.碳酸钙受热分解 B.钠和H2O反应
C.NH4Cl晶体和氢氧化钡晶体的反应 D.CO2和C反应
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.已知HI(g)
 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
难度: 困难查看答案及解析
-
如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )
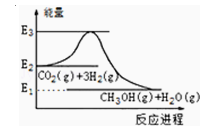
A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
难度: 简单查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H—H、O=O和O—H键的键能分别为436 kJ
 mol-1,496 kJ
mol-1,496 kJ mol-1和462 kJ
mol-1和462 kJ mol-1。则a为 ( )
mol-1。则a为 ( )A.-332 B.-118 C.+350 D.+130
难度: 简单查看答案及解析
-
下列有关反应速率的说法中正确的是( )
A.合成氨工业中使用合适催化剂可以提高反应速率以及增大该反应的限度
B.等质量的锌粉和锌片与相同体积、相向浓度的盐酸反应,反应速率相等
C.用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D.已知二氧化硫催化氧化反应的△H<0,则升高温度,反应速率增大
难度: 简单查看答案及解析
-
一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
3
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是( )(溶液体积变化忽略不计)
A.反应至6min时,H2O2分解了50%
B.反应至6min时,c(H2O2)=0.20 mol·L-1
C.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D.4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
难度: 中等查看答案及解析
-
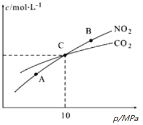
已知反应N2O4(g)
 2NO2(g) △H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57kJ/mol,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )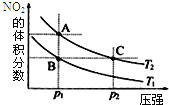
A.A、C两点气体的平均相对分子质量:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点的反应速率:A>C
难度: 简单查看答案及解析
-
CO(g)+Cl2(g)⇌COCl2(g) △H<0,当反应达到平衡时,下列措施:①升温、②加压、③增加Cl2的浓度④加催化剂⑤恒压通入惰性气体⑥恒容通入惰性气体,能提高CO转化率的是( )
A.②③ B.③⑤ C.①④ D.③⑥
难度: 简单查看答案及解析
-
高温下,某反应达平衡,平衡常数K=
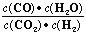 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是A.该反应的焓变为正值
B.升高温度,逆反应速率减小
C.恒温恒容下,增大压强,H2浓度一定减小
D.该反应化学方程式为CO+H2O
 CO2+H2
CO2+H2难度: 中等查看答案及解析
-
已知下列反应的平衡常数:H2(g)+S(s)
 H2S(g),K1;S(s)+O2(g)
H2S(g),K1;S(s)+O2(g)  SO2(g),K2。则反应H2(g)+SO2(g)
SO2(g),K2。则反应H2(g)+SO2(g)  O2(g)+H2S(g)的平衡常数为( )
O2(g)+H2S(g)的平衡常数为( )A.K1+K2 B.K1-K2 C.K1×K2 D.
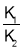
难度: 中等查看答案及解析
-
下列关于化学反应方向及其判据的说法错误的是
A.1 mol H2O在不同状态时的熵值: S[H2O(s)]<S[H2O(g)]
B.通常情况下,一个放热且熵增的反应也有可能非自发进行
C.2KClO3(s)=2KCl(s)+3CO2(g) △H>0 能否自发进行与温度有关
D.某温度下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
 2C(g) ΔH<0,下列各图正确的是
2C(g) ΔH<0,下列各图正确的是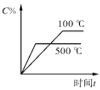 B.
B.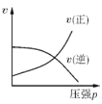 C.
C.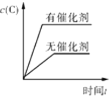 D.
D.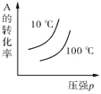

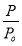 )随时间(t)的变化曲线,曲线中的两个点的坐标分别为(5,0.925)和(10,0.90)。平衡时NO的转化率为________
)随时间(t)的变化曲线,曲线中的两个点的坐标分别为(5,0.925)和(10,0.90)。平衡时NO的转化率为________