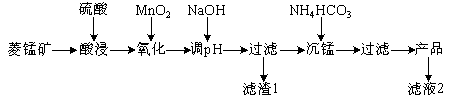
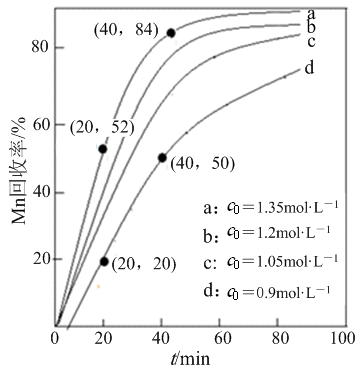
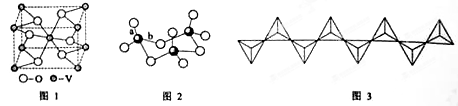
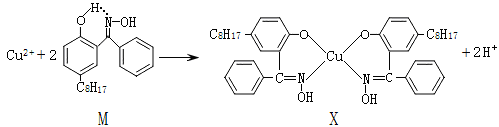
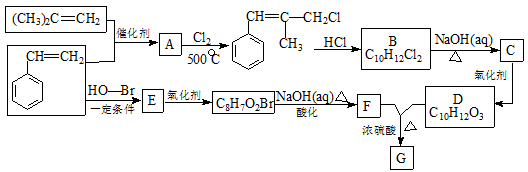
-
战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A.CaO B.NaHCO3 C.SiO2 D.CaCO3
难度: 简单查看答案及解析
-
茅台酒中存在少量具有凤梨香味的物质X,其结构如下图所示。下列说法正确的是
A.X难溶于乙醇
B.酒中的少量丁酸能抑制X的水解
C.分子式为C4H8O2且官能团与X相同的物质有5种
D.X完全燃烧后生成CO2和H2O的物质的量比为1∶2
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生右图所示变化,其中B和C均为10电子分子。下列说法不正确的是
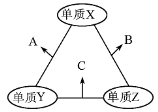
A.X元素位于ⅥA族
B.A难溶于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
难度: 中等查看答案及解析
-
下图是一种蓄电池的示意图。被膜隔开的电解质分别为Na2S2和NaBr3,放电后变为Na2S4和NaBr。已知放电时Na+ 由乙池向甲池移动。下面对该装置工作过程中叙述正确的是
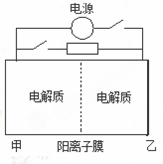
A.放电过程,甲池发生氧化反应
B.放电过程,电池反应:2S22-+ Br3-= S42-+ 3Br-
C.充电过程,乙池为阳极室
D.充电过程,当阳极室阴离子增加2mol,整个电路中电子转移2mol
难度: 中等查看答案及解析
-
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法,正确的一组为
序号
物质
杂质
除杂质应选用的试剂或操作方法
A
C2H5Br
C2H5OH
用水洗涤、分液
B
FeCl3
CaCO3
溶解、过滤、蒸发结晶
C
Al2(SO4)3溶液
MgSO4
加入过量烧碱后过滤,再用硫酸酸化滤液
D
CO2
SO2
通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶
难度: 中等查看答案及解析
-
常温下体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是
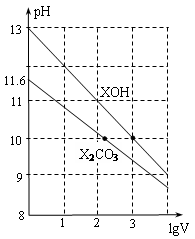
A.pH=10的两种溶液中的c(X+):XOH大于X2CO3
B.已知常温下,0.1 mol·L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)·Ka2(H2CO3) >Kw
C.已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
难度: 极难查看答案及解析
-
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法正确的是

A.一定含有Al,其质量为4.05g
B.一定不含FeCl2,可能含有MgCl2和AlCl3
C.一定含有MgCl2和FeCl2
D.一定含有(NH4)2SO4和MgCl2,且物质的量相等
难度: 极难查看答案及解析
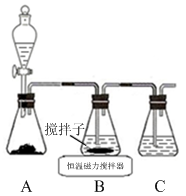

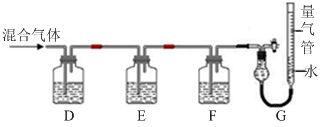
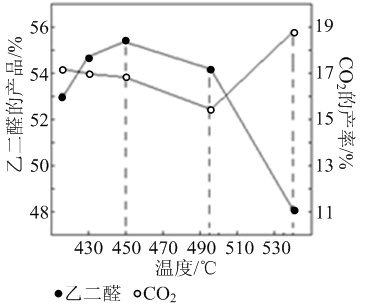
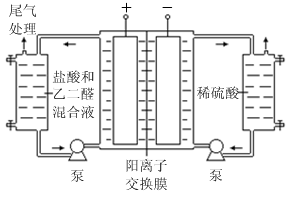
 )
)