-
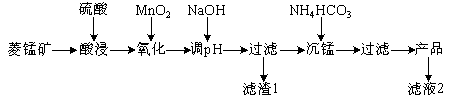
以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1 的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
② “沉锰”前溶液中c(Mn2+) = mol·L−1(列出表达式)。
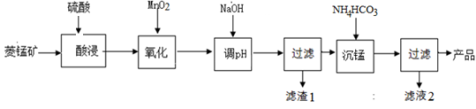
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
① NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
② 若溶液中c(Mn2+) = 1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+) = 。
-
以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。
(已知:Ksp(MnCO3)=2.2×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38)
(1)滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
(2)滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
①Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
②“沉锰”前溶液中c(Mn2+)= mol·L-1。
(4)其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
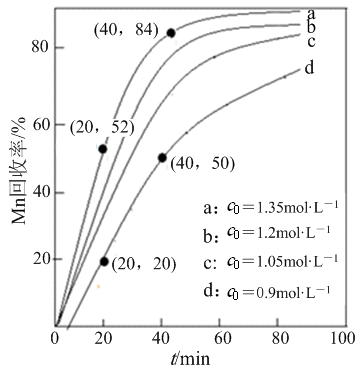
①NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
②若溶液中c(Mn2+)=1.0 mol·L-1,加入等体积1.8 mol·L-1 NH4HCO3溶液进行反应,计算20~40 min内v(Mn2+)= 。
-
以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品:
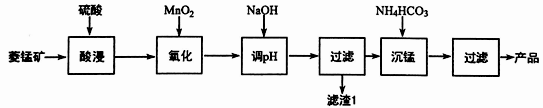
(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有___________________。(写出一种)
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中 ___________________(填化学式)的含量减少。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为___________________________________________。
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=_______________。
(4)①写出“沉锰”时的离子方程式:___________________________________________。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因___________________________________________。
-
MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
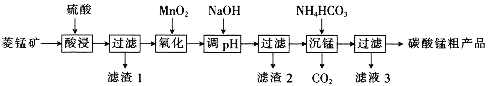
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
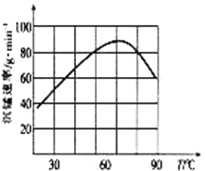
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
-
MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:
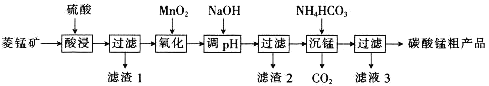
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。

(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
-
MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为__________________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。
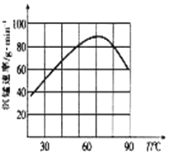
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是___________________。
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为___________________。
-
MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。
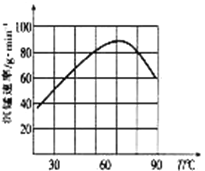
(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
-
某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
已知:MnCO3+2NH4Cl  MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
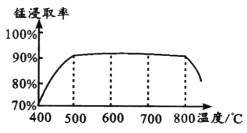
焙烧时适宜温度为_____ ;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4,发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
-
某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要流程如下:
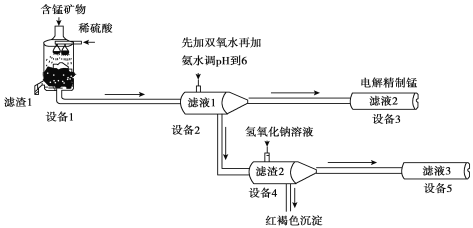
(1)为提高含锰矿物浸出速率,可采取的措施有______________(至少写出两条)。
(2)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。设备1中发生氧化还原反应的离子方程式是______________________________________。
(3)设备2中加足量双氧水的作用是________________________。设计实验方案检验滤液2中是否存在Fe2+________________________。
(4)已知金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,加氨水调节溶液的pH等于6,滤渣2的主要成分为_____________ (填化学式)。
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
(5)设备4中加入过量氢氧化钠溶液,用离子方程式表示发生的反应______________。
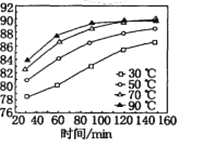
(6)保持其他条件不变,在不同温度下对含锰矿物进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。
-
某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:
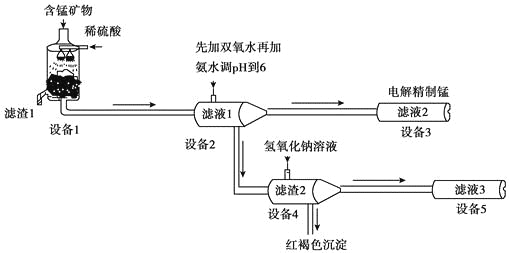
(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是_______(填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是_______。
(3)设备2中加足量双氧水的作用是_______。设计实验方案检验滤液2中是否存在Fe2+:_______。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因:_______。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:
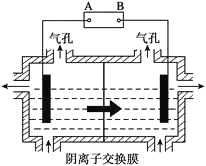
① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的_______极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为___________。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______________。


















