-
某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
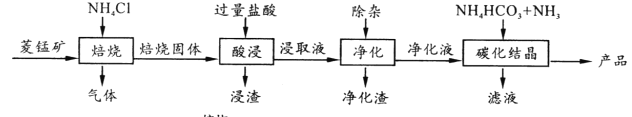
已知:MnCO3+2NH4Cl  MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
(1)焙烧时温度对锰浸取率的影响如图。
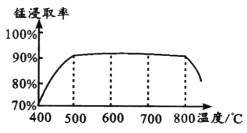
焙烧时适宜温度为_____ ;800℃以上锰的浸取率偏低,可能原因是________。
(2)净化包含三步: ①加入少量MnO2,反应的离子方程式为___;
②加氨水调pH,生成沉淀主要是_________;
③加入NH4F,除去Ca2+、Mg2+。
(3)碳化结晶中生成MnCO3的离子方程式为___________。
(4)滴定法测产品纯度
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4,发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I-,滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是____________。
②假设杂质不参与反应,则产品纯度为________。
-
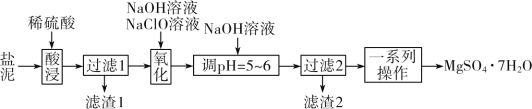
以某工业副产物盐泥[主要成分为Mg(OH)2,还含有少量Al(OH)3、FeCO3、MnCO3、SiO2、CaCO3等]为原料制备防火材料MgSO4·7H2O的工艺流程如图:
回答下列问题:
(1)以MgSO4为原料可制备阴、阳离子个数比为1:1的化合物MgC2。已知MgC2中各元素原子都达到了稳定结构,则MgC2的电子式为__。
(2)“酸浸”时,FeCO3与稀硫酸反应的化学方程式为__。滤渣1的主要成分为SiO2和__(填化学式);为了提高浸取率,除了适当增大稀硫酸的浓度和升温外,还可采取的措施有__(写出两点)。
(3)“氧化”时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__;滤渣2的主要成分为MnO2和__、__(填化学式)。
(4)“一系列操作”主要是__。
(5)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明其可做防火材料的原理:__。
-
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
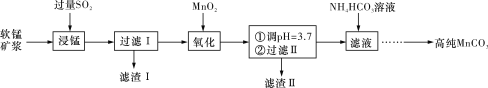
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
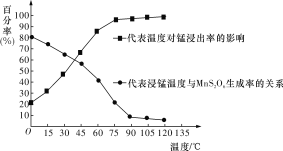
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
-
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下图所示:
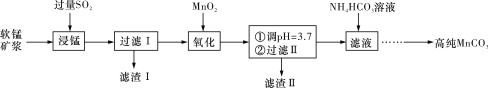
(1)“过滤Ⅰ”所得“滤渣Ⅰ”的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式______________________________________________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是____________________________________。
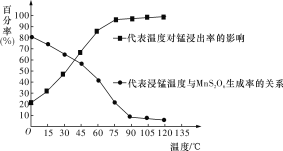
(4)向“过滤Ⅱ”所得的滤液中加入NH4HCO3溶液时温度控制在30~35 ℃,温度不宜太高的原因是_________________________________________________________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________________________________________________________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验沉淀是否洗涤干净的方法是___________________________________________________________________________。
-
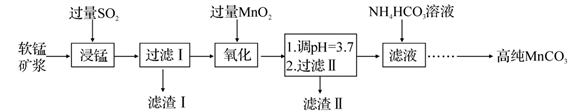
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
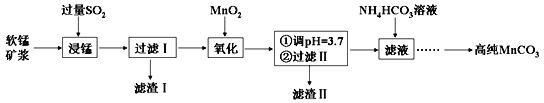
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
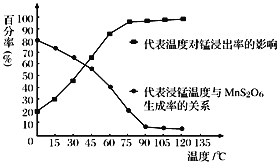
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
-
工业以软锰矿(主要成分是 MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
已知:25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH 如下表所示。
| 金属阳离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)“浸锰”过程中 Fe2O3与SO2反应的离子方程式为 Fe2O3+SO2+2H+ =2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
写出ⅱ的离子方程式:_______________________。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_________ (填离子符号)。
(3)写出“氧化”过程中MnO2 与Fe 2+反应的离子方程式:___________。
(4)“浸锰”反应中往往有副产物 MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是;_____滤渣Ⅱ的成分是______ (写化学式);向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度不宜太高的原因是______________。
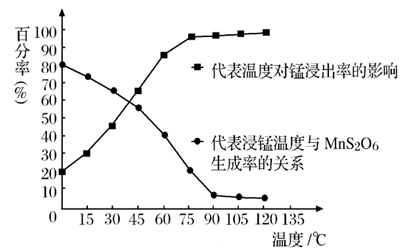
(5)加入NH4HCO3溶液后,生成 MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:__________________ 。
(6)生成的 MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________。
-
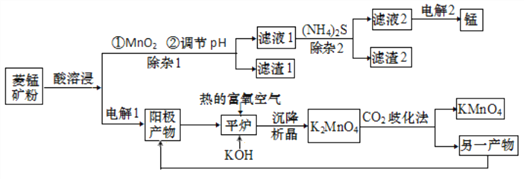
锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:
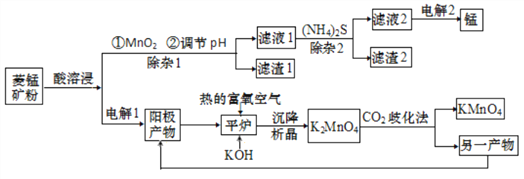
已知 25 ℃时,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________(任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________;滤渣2 的主要成分是____________________________。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______。
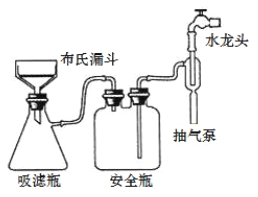
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________。
-
锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:
已知 25 ℃时,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________(任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________;滤渣2 的主要成分是____________________________。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______。
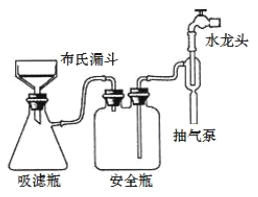
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________。
-
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
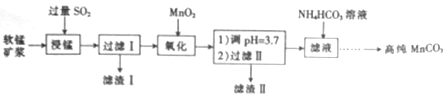
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____和_____(填离子符号)。
(2)写出氧化过程中MnO2与SO2反应的化学方程式:____________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___________。
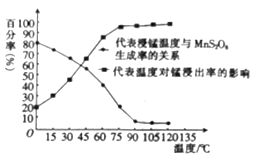
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_________________。
-
工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
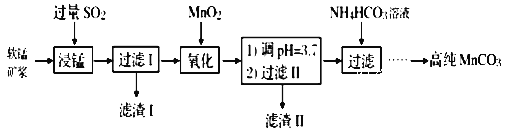
(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____和_____(填离子符号)。
(2)写出氧化过程中MnO2与SO2反应的化学方程式:____________。
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___________。
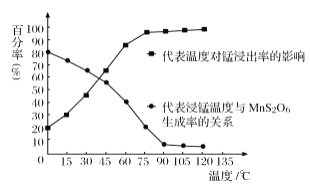
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30-35℃,温度不宜太高的原因是___。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______。

MnCl2 +CO2 ↑+2NH3 ↑+H2O↑

















