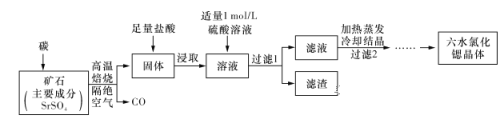
-
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。请你据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. NH4CuSO3中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1 mol NH4CuSO3完全反应转移0.5 mol电子
难度: 中等查看答案及解析
-
分子式为C4H8O2且能与NaOH溶液发生水解反应的有机物有(不考虑空间异构)
A. 6种 B. 5种 C. 4种 D. 3种
难度: 中等查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。5种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数是W的2倍。工业上一般通过电解氧化物的方法获得Y的单质。则下列说法不正确的是( )
A. 原子半径:X>Y>Q>W
B. Q的单质都具有良好的导电性
C. Q和Z所形成的分子的空间构型为直线形
D. 化合物Y2Z3不能在水中稳定存在
难度: 中等查看答案及解析
-
有些古文或谚语包含了丰富的化学知识,下列解释不正确的是
选项
古文或谚语
化学解释
A
日照香炉生紫烟
碘的升华
B
以曾青涂铁,铁赤色如铜
置换反应
C
煮豆燃豆萁
化学能转化为热能
D
雷雨肥庄稼
自然固氮
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列排列顺序正确的是( )
A. 电离出氢离子的能力:CH3COOH>C2H5OH>H2O
B. 微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C. 固体的热稳定性:Na2CO3>CaCO3>NaHCO3
D. 氢化物的沸点:H2Se>H2S>H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下33.6L氯气与27g铝充分反应,转移的电子数为3NA
B. 标准状况下,28g乙烯和丙烯的混合气体中所含原子个数为4NA
C. 一定条件下,将1molN2与3molH2混合反应后,生成NH3分子的数目为2NA
D. 在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1L,在阳极析出的气体分子数约为0.25NA
难度: 中等查看答案及解析
-
室温下,下列各组微粒在指定溶液中能大量共存的是( )
A. pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42-
B. c(Ca2+)=0.1 mol·L-1的溶液中:NH4+、SiO32-、C2O42-、Br-
C. 加入铝粉放出大量H2的溶液中:Fe2+、Na+、Cl-、NO3-
D. NaHCO3溶液中: C6H5O-、CO32-、Br-、K+
难度: 中等查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将2 mol Cl2通入含1 mol FeI2的溶液中:
2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2
正确;Cl2过量,可将Fe2+、I-均氧化
B
Ba(HCO3)2溶液与足量的NaOH溶液反应:
Ba2++HCO3-+OH-===BaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
C
过量SO2通入NaClO溶液中:
SO2+H2O+ClO-===HClO+HSO3-
正确;说明酸性:H2SO3强于HClO
D
1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:
2AlO2-+5H+===Al3++Al(OH)3↓+H2O
正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )
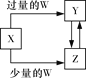
选项
W
X
A
稀硫酸
NaAlO2溶液
B
稀硝酸
Fe
C
CO2
Ca(OH)2溶液
D
Cl2
Fe
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
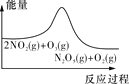
臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)
 N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )A
B
C
D
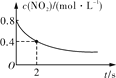
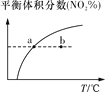
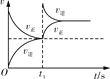
平衡后升温,NO2含量降低
0~2 s内,v(O3)=0.2 mol·L-1·s-1
v正:b点>a点
b点:v逆>v正
恒温,t1时再充入O3
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为
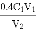 mol/L
mol/LD. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
难度: 中等查看答案及解析
-
若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
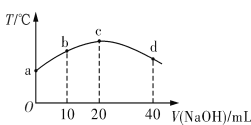
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
难度: 困难查看答案及解析
-
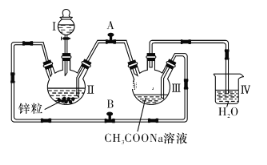
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
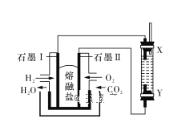
A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中的电解液为蒸馏水
D. 若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理
难度: 中等查看答案及解析
-
已知在常温下测得浓度均为0.1 mol/L的下列6种溶液的pH值如表所示:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.8
9.7
11.6
10.3
11.1
11.3
下列反应不能成立的是( )
A. CO2+H2O+2NaClO===Na2CO3+2HClO
B. CO2+H2O+NaClO===NaHCO3+HClO
C. CO2+H2O+C6H5ONa===NaHCO3+C6H5OH
D. CH3COOH+NaCN===CH3COONa+HCN
难度: 中等查看答案及解析
-
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol • L-1。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为( )(反应前后溶液体积变化忽略不计)
A. 0.225 mol • L-1 B. 0.30 mol • L-1 C. 0.36 mol • L-1 D. 0.45 mol • L-1
难度: 简单查看答案及解析
-
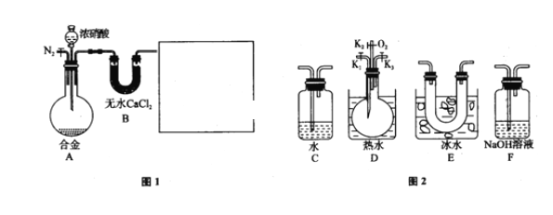
实验室用H2还原SiHCl3(沸点:31.85 ℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )
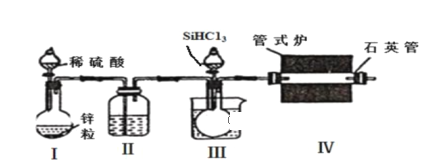
A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,用到的试剂可以为:盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氢氧化钠稀溶液与氯化铵固体反应制备氨气
难度: 困难查看答案及解析
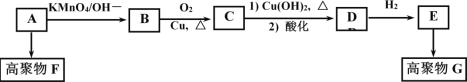
 HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题: