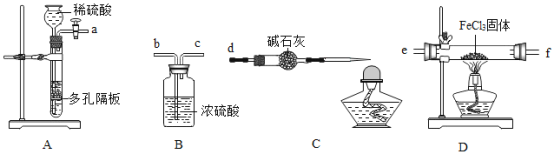
-
分类是化学学习、研究的重要方法。下列有关分类正确的是( )
A.塑料、合成纤维、合成橡胶是合成材料
B.氯化钠、苛性钠、纯碱是盐
C.磁铁矿、二氧化锰、二氧化碳是氧化物
D.钙、铁、锌、硒是人体中的微量元素
难度: 简单查看答案及解析
-
氮化镓(GaN)是第三代半导体材料的典型代表。它具有高的导热率,化学性质稳定等性质。下列叙述错误的( )
A.氮化镓是一种合金 B.氮化镓是化合物
C.氮化镓具有导热性 D.氮化镓不易被氧化
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.地壳中含量最多的金属元素是Si B.“高钙牛奶”中的“钙”应理解为原子
C.氯化钠是由氯化钠离子构成的 D.Fe3+表示一个铁离子
难度: 简单查看答案及解析
-
对下列一些事实的解释错误的是
序号
事实
解释
A
医疗器械可用沸水消毒
蛋白质受热失去生理功能
B
氨气易被压缩
分子在不断运动
C
白磷有毒,红磷无毒
两种物质的分子构成不同
D
硫酸铁溶液呈黄色,硫酸亚铁溶液呈浅绿色
两种溶液中的阳离子不同
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
亚硒酸钠(Na2SeO3)可用于提升人体免疫力,硒元素在元素周期表中的部分信息及原子结构示意图如图所示,下列说法正确的是( )
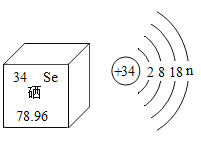
A.Na2SeO3中Se的化合价为+3 B.Se是一种金属元素
C.n的值为6 D.Se相对原子质量为78.96g
难度: 简单查看答案及解析
-
程浩同学查阅资料得知:Cu 与稀硫酸不反应,但Cu可与浓硫酸在加热的条件下反应,化学方程式为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2R,下列说法中不正确的是
CuSO4+SO2↑+2R,下列说法中不正确的是A. 该反应中涉及了3种类型的化合物
B. R为相对分子质量最小的氧化物
C. 反应前后,H2SO4中硫的化合价全部发生了改变
D. 该反应不属于四种基本反应类型中的任何一种
难度: 中等查看答案及解析
-
如图中“—”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,部分反应物、生成物及反应条件未标出。则不可能出现的情况是()

A.甲是H2,乙是O2 B.甲是HNO3,丙是NaNO3
C.乙是CO,丙是CO2 D.乙是Cu(OH)2,丙是CuSO4
难度: 中等查看答案及解析
-
下列实验方案,不能达到相应实验目的是( )
A.
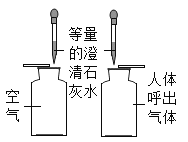 比较空气与人体呼出的气体中CO2含量
比较空气与人体呼出的气体中CO2含量B.
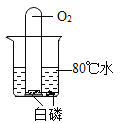 验证燃烧需要温度达到着火点
验证燃烧需要温度达到着火点C.
 探究MnO2能否加快H2O2分解
探究MnO2能否加快H2O2分解D.
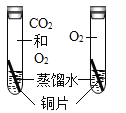 探究CO2对铜生锈是否有影响
探究CO2对铜生锈是否有影响难度: 中等查看答案及解析
-
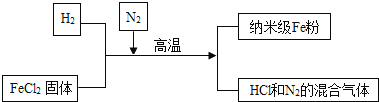
科学家最新发现,通过简单的化学反应,可以将树木纤维素转变为超级储能装置,如图是该反应的微观示意图,下列说法错误的是( )
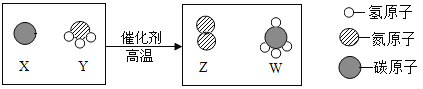
A.参加反应的X、Y两物质的粒子个数之比为3∶4
B.该反应属于置换反应
C.W物质中碳元素的质量分数为75%
D.该反应的化学方程式可表示为:3C+4NH3=2N2+3CH4
难度: 简单查看答案及解析
-
如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
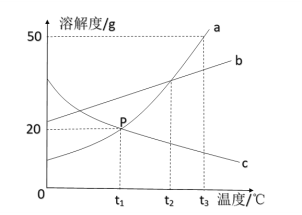
A.t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C.将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D.将150g a物质的饱和溶液从t3℃降温至t1℃,可析出30g a物质
难度: 中等查看答案及解析
-
中考复习阶段,某同学梳理了以下知识:①用食盐水制作叶脉书签;②仅用酚酞溶液可以鉴别稀盐酸、氢氧化钠溶液和氯化钠溶液;③合金的熔点和硬度均高于组成它们的纯金属;④用果汁、食品级小苏打、柠檬酸、凉开水等自制汽水;⑤鉴别甲烷、 一氧化碳、氢气分别点燃后,观察火焰颜色; ⑥ 磷肥可以促进作物生长,还可增强作物的抗病虫害和抗倒伏能力⑦浓硫酸、烧碱、生石灰、 澄清石灰水分别存放在烧杯中一段时间后,烧杯中物质质量都会变大且变质。上面说法正确的个数是( )
A.1个 B.2个 C.3个 D.4个
难度: 简单查看答案及解析
-
下列实验能达到相应目的是( )
A.分离Zn和Cu的固体混合物 :加适量的Cu(NO3)2溶液,过滤
B.除去CaCl2溶液中少量的HCl :加过量Ca(OH)2固体,过滤
C.验证BaSO4中含有BaCO3:取样,加适量稀盐酸有气泡产生
D.制备Cu(OH)2:将CuSO4溶液和适量Ba(OH)2溶液混合,过滤
难度: 中等查看答案及解析