-
化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是
A.垃圾分类中,易拉罐、过期药品属于可回收垃圾,剩饭剩菜等属于厨余垃圾,旧课本、荧光灯管属于有害垃圾
B.“地沟油”有毒,但可以用于生产生物燃料
C.纯棉衬衣、塑料水管、牛皮鞋均与有机高分子化合物有关
D.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
难度: 中等查看答案及解析
-
科学防护对预防新冠病毒感染非常重要,下列说法正确的是
A.冠状病毒粒子直径约60~220nm,故介于溶液和胶体粒子之间
B.制作防护服和口罩的无纺布是无机高分子材料
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.酒精、双氧水能杀菌消毒,都利用了它们的强氧化性
难度: 简单查看答案及解析
-
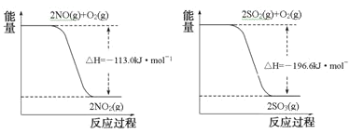
下列属于吸热反应的是
A.冰的熔化 B.高温下CaCO3分解 C.醋酸和氨水混合 D.氮气、氢气合成氨气
难度: 简单查看答案及解析
-
用你所学的化学知识判断下列表述,其中不正确的是
A.乙烯、乙醛和硝基苯都能发生加成反应 B.甲烷、苯、蔗糖均能被氧化
C.所有糖、油脂和蛋白质均能发生水解反应 D.镀锌铁管的镀层破损后,残余的锌仍能起保护作用
难度: 中等查看答案及解析
-
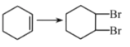
与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是( )
A.环丙烷 B.环丁烷 C.乙烯 D.丙烷
难度: 中等查看答案及解析
-
分子式与苯丙氨酸(下图)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上的同分异构体的数目为
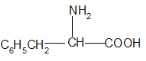
A.3种 B.6种 C.8种 D.10种 、
难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。下表是某温度下这四种酸在冰醋酸中的电离常数,由表格数据判断以下说法中不正确的是
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
A.相同条件下在冰醋酸中,硝酸是这四种酸中最弱的酸
B.在冰醋酸中,这四种酸都没有完全电离
C.在冰醋酸中,硫酸的电离方程式为H2SO4⇌H++
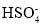 、
、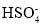 ⇌H++
⇌H++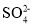
D.电解质的强弱与所处的溶剂无关
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列判断正确的是()
A.常温下,lLpH=l的盐酸溶液中,由水电离的H+数为10-13NA
B.物质的量浓度为0.lmol•L-1的MgCl2溶液中,含有的Mg2+个数少于0.lNA
C.标准状况下,碳原子总数为0.lNA的CO2和CCl4的混合物,其体积为4.48L
D.100g46%乙醇水溶液中,所含O—H数目为NA
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.顺丁橡胶(顺式聚1,3-丁二烯)、,尿不湿(聚丙烯酸钠)、电木(酚醛树脂)都是由加聚反应制得的
B.乳酸(
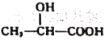 )通过加聚反应可制得可降解的聚乳酸塑料
)通过加聚反应可制得可降解的聚乳酸塑料C.合成酚醛树脂(
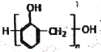 )的单体是苯酚和甲醇
)的单体是苯酚和甲醇D.聚氯乙烯可制成薄膜、软管等;其单体是CH2=CHCl
难度: 中等查看答案及解析
-
下列说法不正确的是
A.向卤代烃水解后的溶液中加入硝酸,再加硝酸银液,可以确定卤代烃中含有哪种卤元素
B.用酸性KMnO4溶液(必要时可加热)能鉴别四氯化碳、甲苯、乙醇
C.用甘氨酸(H2N-CH2-COOH)和苯丙氨酸(
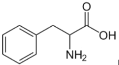 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
难度: 中等查看答案及解析
-
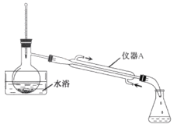
实验室制备溴苯的反应装置如图所示,关于实验操作或叙述错误的是

A.向圆底烧瓶中滴加苯和溴的混合液时,需打开分液漏斗的顶塞或使顶塞上的凹槽与壁上小孔对齐
B.装置b的主要作用是除去溴化氢中的溴蒸气
C.装置c中的倒置漏斗主要是为了加速溴化氢的溶解,
D.反应后的混合液经水洗、分液、稀碱液洗涤、分液、蒸馏,得到溴苯
难度: 中等查看答案及解析
-
萤火虫发光原理如下:
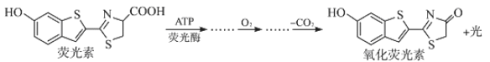
关于荧光素及氧化荧光素的叙述,不正确的是
A.互为同分异构体 B.均可发生硝化反应
C.均可与碳酸钠反应 D.一定共平面的碳原子均不少于7个
难度: 简单查看答案及解析
-
香草醛是一种食品添加剂.,可由愈创木酚作原料合成,、合成路线如图所示。关于香草醛的合成路线,下列说法不正确的是

A.理论上物质1→2,原子利用率为100%
B.化合物2可发生氧化、还原、取代、加成、消去、缩聚反应
C.检验制得的香草醛中是否混有化合物3,不可用氯化铁溶液
D.等物质的量的四种化合物分别与足量NaOH反应,消耗NaOH的物质的量之比为1:2:2:1
难度: 中等查看答案及解析
-
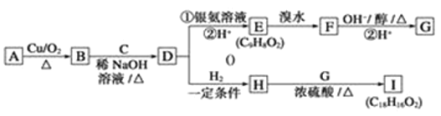
有机物m、n、p存在如下转化关系。下列说法正确的是

A.m、n、p中所有原子不可能共面
B.n不存在同分异构体,m、p均存在同分异构体
C.等质量的m、n、p,完全燃烧耗氧量不相等
D.m、n、p均能由化学反应而使溴水褪色
难度: 中等查看答案及解析
-
某天然油脂的分子式为C57H106O6,lmol该油脂水解可得到lmol甘油、lmol脂肪酸X、2mol脂肪酸Y。经测定X的相对分子质量为284,原子个数比为C:H:O=9:18:1,下列说法不正确的是
A.X的分子式为C18H36O2 B.此天然油脂能与氢气反应
C.Y的结构简式可能为CH3(CH2)16COOH D.Y的结构简式可能为CH3CH=CH(CH2)14COOH
难度: 困难查看答案及解析
-
25℃时,向20mL0.lmol•L-1H3PO2溶液中滴加0.lmol•L-1的NaOH溶液,滴定曲线如图1,各种含磷微粒占含磷微粒总量的物质的量分数(δ)随pH变化关系如图2(已知a点的纵坐标为0.5)。下列说法正确是
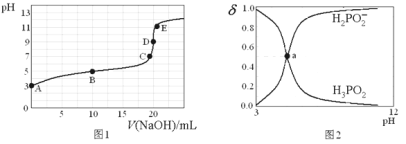
A.a点溶液显中性
B.已知B点所加NaOH液为l0mL,则该点溶液中存在关系:2c(H+)+c(
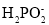 )=2c(OH-)+c(H3PO2)
)=2c(OH-)+c(H3PO2)C.已知D点所加NaOH液为20mL,则该点溶液中微粒浓度大小关系:c(Na+)>c(
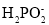 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)D.E点溶液中的水解方程式为
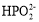 +H2O⇌
+H2O⇌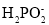 +OH-
+OH-难度: 中等查看答案及解析

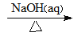
 +H2O。
+H2O。 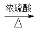 CH≡C—COOCH3+H2O
CH≡C—COOCH3+H2O