-
下列微粒中,能表示2个氢分子的是
A. 2H B. 2H+ C. H2O D. 2H2
难度: 中等查看答案及解析
-
下列物质中,含有氧分子的是
A.O2 B.H2O C.CO2 D.H2O2
难度: 简单查看答案及解析
-
已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为
A. 2 B. 6 C. 8 D. 14
难度: 简单查看答案及解析
-
决定元素种类的是
A.中子数 B.质子数 C.核外电子数 D.最外层电子数
难度: 简单查看答案及解析
-
氢氧化钠是重要的化工原料,其俗称是
A.纯碱 B.烧碱 C.小苏打 D.熟石灰
难度: 简单查看答案及解析
-
下列操作中,能鉴别空气、氧气和氢气3瓶气体的是
A.观察气体颜色 B.插入燃着的木条
C.闻气体的气味 D.倒入澄清石灰水
难度: 简单查看答案及解析
-
下列物质性质的表述中,属于化学性质的是
A.氧气无色无味 B.铝呈银白色
C.蔗糖易溶于水 D.碳酸易分解
难度: 简单查看答案及解析
-
每年5月31日为世界无烟日。吸烟有害健康,烟气中的一种有毒气体是
A.O2 B.N2 C.CO D.CO2
难度: 简单查看答案及解析
-
“绿色化学”能实现零排放(即反应物中的原子利用率达到100%).CO和H2在一定条件下按照不同的比例可以合成不同的有机化工原料.根据零排放的要求,以CO和H2合成的有机物不可能是( )
A.甲醇(CH4O) B.乙醇(C2H6O)
C.甲醛(CH2O) D.乙酸(C2H4O2)
难度: 中等查看答案及解析
-
小刚测定了下列4种日用品的pH,其中呈酸性的是
日用品
A.洁厕灵
B.洗涤灵
C.洗发水
D.消毒液
pH
1
7
9
12
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质的用途中,利用其化学性质的是( )
A.干冰用于人工降雨 B.天然气用作燃料
C.液氮用作冷冻剂 D.银用于制作导线
难度: 简单查看答案及解析
-
下列变化中,属于化学变化的是
A.矿石粉碎 B.纸张燃烧 C.酒精挥发 D.冰雪融化
难度: 简单查看答案及解析
-
空气中体积分数约占78%的气体是
A.二氧化碳 B.氮气 C.氧气 D.稀有气体
难度: 极难查看答案及解析
-
下列物质中,属于纯净物的是( )
A.
 矿泉水 B.
矿泉水 B. 苏打水 C.
苏打水 C. 白醋 D.
白醋 D. 蒸馏水
蒸馏水难度: 简单查看答案及解析
-
下列物质中,能用作钾肥的是 ( )
A.K2SO4 B.CO(NH2)2 C.NH4NO3 D.Ca(H2PO4)3
难度: 简单查看答案及解析
-
下列物质敞口放置,质量会减轻的是
A.氢氧化钠 B.浓硫酸 C.浓盐酸 D.碳酸钙
难度: 简单查看答案及解析
-
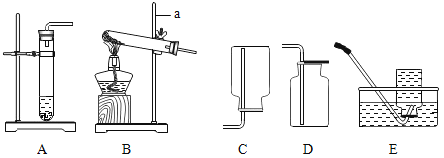
下列实验操作中,正确的是
A.
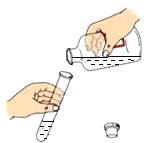 倾倒液体 B.
倾倒液体 B.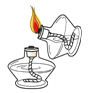 点燃酒精灯 C.
点燃酒精灯 C.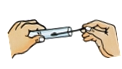 取用固体粉末 D.
取用固体粉末 D.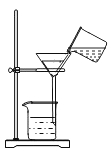 过滤
过滤难度: 简单查看答案及解析
-
下列化学方程式中,书写正确的是
A.2H2O=2H2↑+ O2↑
B.H2SO4 + NaOH=NaSO4 + H2O
C.Fe + HCl=FeCl2 + H2↑
D.2KMnO4
 K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑难度: 中等查看答案及解析
-
垃圾分类从我做起。金属饮料罐属于( )
A.
 可回收物 B.
可回收物 B.  有害垃圾 C.
有害垃圾 C.  厨余垃圾 D.
厨余垃圾 D.  其他垃圾
其他垃圾难度: 简单查看答案及解析
-
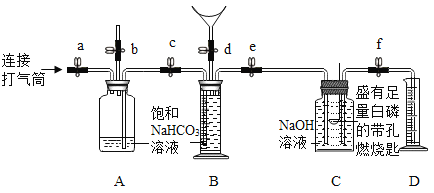
对下图所示实验现象进行分析得出的结论中,错误的是( )
A.
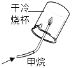 甲烷燃烧生成二氧化碳和水
甲烷燃烧生成二氧化碳和水B.
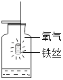 铁能在氧气中燃烧
铁能在氧气中燃烧C.
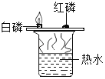 白磷的着火点比红磷的低
白磷的着火点比红磷的低D.
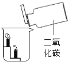 二氧化碳的密度比空气大,不燃烧也不支持燃烧
二氧化碳的密度比空气大,不燃烧也不支持燃烧难度: 困难查看答案及解析
-
汽车尾气中的CO在四氧化三钴(Co3O4)纳米棒的催化作用下,低温即与O2反应生成CO2。下列关于该反应的说法中,不正确的是
A.反应类型为化合反应
B.可降低汽车尾气对大气的污染
C.反应前后Co3O4质量改变
D.反应前后碳元素的化合价改变
难度: 中等查看答案及解析
-
下表各组中,实验操作和目的对应关系不正确的是
A.
加热试管时,先均匀加热后集中加热
防止试管炸裂
B.
量取液体时,视线与凹液面最低处保持水平
防止读数误差
C.
铁丝在氧气中燃烧时,集气瓶底部放少量水
使实验现象更加明显
D.
用双氧水制氧气时,加入少量二氧化锰
加快氧气生成速度
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
工业上用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是( )
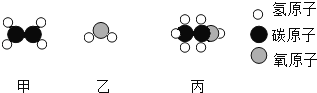
A. 甲的化学式为CH2
B. 反应中甲、乙、丙的分子个数比为2:1:1
C. 甲、乙、丙都可能是氧化物
D. 丙中C、H、O元素的质量比12:3:8
难度: 中等查看答案及解析
-
氨基钠(NaNH2)是合成维生素 A 的原料。工业上将金属钠于 97~100℃熔融,向反应容器中缓慢通入无 水的液氨(NH3),再加热至350~360℃,生成氨基钠和氢气。下列说法中,不正确的是 ( )
A.钠可能与水反应
B.钠的熔点比铁的熔点低
C.维生素 A 中一定含有钠元素
D.反应的化学方程式为2Na2NH3
 2NaNH2H2
2NaNH2H2难度: 中等查看答案及解析
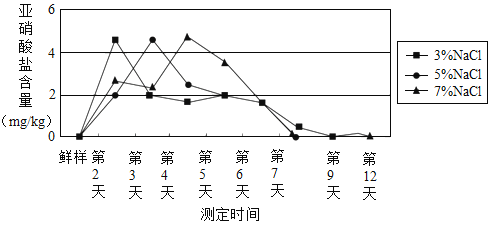
 Pb2H2SO4+(_____)。
Pb2H2SO4+(_____)。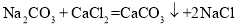 ,CaCl2 不与 NaCl 反应。
,CaCl2 不与 NaCl 反应。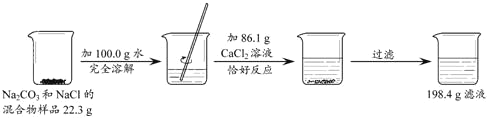
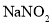 )]与胃酸(主要成分是盐酸)反应,产生亚硝酸(
)]与胃酸(主要成分是盐酸)反应,产生亚硝酸(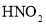 )和氯化物(如
)和氯化物(如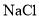 )。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。
)。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。