-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.1mol KClO3参加反应有2 mol电子转移
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒
C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查
难度: 简单查看答案及解析
-
在含有Fe3+、Fe2+、Al3+、NH4+稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有变化的是
A.Fe2+ B.Al3+ C.Fe3+ D.NH4+
难度: 中等查看答案及解析
-
既能与稀盐酸反应,又能跟氢氧化钠溶液反应的化合物是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
分类是化学学习和研究的常用方法。下列分类依据和结论都正确的是
A.H2O、CH3COOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
B.溶液、胶体、浊液均为分散系,都属于混合物
C.Al、Al2O3、Al(OH)3均能与盐酸反应又能与氢氧化钠溶液反应,都是具两性的化合物
D.H2SO4、NaOH、NaCl均为强电解质,BaSO4是弱电解质
难度: 简单查看答案及解析
-
下列中学常见实验的现象或表述正确的是
A.过量的铁投入到一定量的稀硝酸中,充分反应后取上层清液于试管中,滴加KSCN溶液,溶液显血红色
B.在酒精灯上灼烧铝箔,会发现熔化的铝不断滴落
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向饱和FeCl3溶液中滴加少量NaOH溶液,煮沸后即可得到红褐色的Fe(OH)3胶体
难度: 简单查看答案及解析
-
下列说法正确的是
A.Na2CO3的热稳定性比NaHCO3强
B.Al2O3既是金属氧化物,也是碱性氧化物
C.氧气和臭氧的相互转化是物理变化
D.利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol
 所含电子数为11NA
所含电子数为11NAB.标准状况下,22.4LH2O所含原子数为3NA
C.1 molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 L N2和O2的混合气体中分子数为0.1NA
难度: 简单查看答案及解析
-
下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH—=
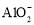 +2H2O
+2H2OC.用铝粉和NaOH溶液反应制取少量H2:Al+2OH−=
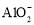 +H2↑
+H2↑D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++
 =2H2O+BaSO4↓
=2H2O+BaSO4↓难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法错误的是
A.3 g 3He含有的中子数为1NA
B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1

C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.同等质量的氧气和臭氧中,电子数相同
难度: 中等查看答案及解析
-
向明矾(KAl(SO4)2·12H2O)溶液中滴入Ba(OH)2溶液,当
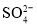 沉淀完全时,铝元素的存在形式是
沉淀完全时,铝元素的存在形式是A.Al(OH)3和Al3+ B.Al(OH)3和
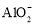
C.全部为Al(OH)3 D.全部为
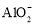
难度: 简单查看答案及解析
-
下列各组离子,在碱性溶液中能大量共存,且溶液为无色透明的是
A.K+、
 、Cl-、
、Cl-、 B.Na+、Ba2+、
B.Na+、Ba2+、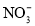 、Cl-
、Cl-C.Na+、
 、Al3+、Cl- D.Na+、Mg2+、
、Al3+、Cl- D.Na+、Mg2+、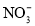 、
、
难度: 简单查看答案及解析
-
重铬酸铵[(NH4)2Cr2O7]是一种受热易分解的盐。下列各项中的物质可能是重铬酸铵受热分解的产物是
A.Cr、NH3、H2O B.Cr2O3、N2、H2O
C.Cr2O3、NH3、H2O D.CrO3、N2、H2O
难度: 中等查看答案及解析
-
钛被誉为“21世纪金属”,工业冶炼钛的第一步反应为TiO2+2C+2Cl2
 TiCl4+2CO。下列关于该反应的说法正确的是( )
TiCl4+2CO。下列关于该反应的说法正确的是( )A.TiO2是氧化剂 B.四氯化钛是还原产物
C.Cl2发生氧化反应 D.氧化剂与还原剂的物质的量之比为1∶2
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L−1NaOH溶液:Na+、K+、
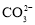 、
、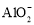
B.0.1 mol·L−1FeCl2溶液:K+、Mg2+、
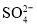 、
、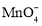
C.0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D.0.1 mol·L−1H2SO4溶液:K+、
 、
、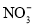 、
、
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
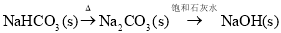
B.
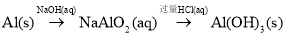
C.Fe
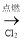 FeCl2
FeCl2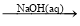 Fe(OH)2
Fe(OH)2D.
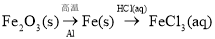
难度: 简单查看答案及解析
-
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③铝与NaOH溶液④硝酸与铁 ⑤氯化铁溶液与铁 ⑥碳酸氢钠溶液与澄清的石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
难度: 中等查看答案及解析
-
在一定条件下PbO2与Cr3+反应,产物是Cr2O
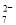 和Pb2+,则与1.0molCr3+反应所需PbO2的物质的量为( )
和Pb2+,则与1.0molCr3+反应所需PbO2的物质的量为( )A.3.0mol B.1.5mol C.1.0mol D.0.75mol
难度: 简单查看答案及解析
-
下列实验过程中沉淀的物质的量(Y)与加入的试剂的量(X)之间的关系正确的是( )

A.如图A:向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.如图B:向NaAlO2溶液中滴加盐酸且边滴边振荡
C.如图C:向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.如图D:向等物质的量的NaOH、Ba(OH)2的混合溶液中逐渐通入二氧化碳至过量
难度: 中等查看答案及解析
-
某植物营养液含有0.2molK+、0.25molZn2+、0.4molCl﹣和
 ,则
,则 的物质的量为( )
的物质的量为( )A.0.1mol B.0.15mol C.0.3mol D.0.5mol
难度: 简单查看答案及解析
 NaNO2+
NaNO2+ ,反应中Na做________(填“还原剂”或“氧化剂”)。
,反应中Na做________(填“还原剂”或“氧化剂”)。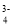 的空间构型为___,中心原子的杂化方式为_____。
的空间构型为___,中心原子的杂化方式为_____。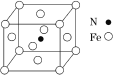
 。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):
。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):