-
同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的组合是( )
①锌粒 ②锌片 ③锌粉 ④5%的盐酸⑤10%的盐酸 ⑥15%的盐酸⑦加热 ⑧使用粗锌代替纯锌⑨不断振荡 ⑩滴入几滴硫酸铜溶液
A. ②⑥⑦⑩ B. ①④⑧⑩ C. ③⑥⑦⑨⑩ D. ③⑥⑦⑧⑨⑩
难度: 中等查看答案及解析
-
下列物质在一定条件下能与甲烷发生取代反应的是
A. 氯气 B. 酸性高锰酸钾溶液
C. 氢氧化钠溶液 D. 溴的四氯化碳溶液
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 化学反应中的能量变化都表现为热量变化
C. 任何放热反应在常温下一定能发生
D. 反应物和生成物所具有的总能量决定了反应是放热还是吸热
难度: 简单查看答案及解析
-
下列各组物质相互间一定互为同系物的是( )
A. 淀粉和纤维素 B. 蔗糖和麦芽糖 C. C3H6与C4H8 D. C4H10与C10H22
难度: 简单查看答案及解析
-
已知原子序数,可以推断原子的( )
①质子数②中子数③质量数④核电荷数⑤核外电子数⑥原子结构示意图⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦ C. ②③④⑤⑦ D. ③④⑤⑥⑦
难度: 简单查看答案及解析
-
下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的粒子,不可能是一种分子与一种离子
④电子数相同的微粒不一定属于同种元素
⑤同种元素的原子的质量数相等
⑥某种元素的相对原子质量取整数,就是其质量数
A. ①②③④ B. ③④⑤⑥ C. ②④⑤⑥ D. ①②⑤⑥
难度: 中等查看答案及解析
-
下列过程因发生取代反应而产生的是( )
A.乙烯使溴的四氯化碳溶液退色
B.将苯加入溴水中,振荡后水层接近无色
C.将苯、浓硫酸、浓硝酸混合后在55~60 ℃ 水浴中加热
D.液态植物油与氢气反应生成固态物质
难度: 简单查看答案及解析
-
元素周期表里金属元素和非金属元素分界线附近的元素可能用于( )
A.制新农药 B.制半导体材料 C.制新医用药物 D.制高温合金
难度: 简单查看答案及解析
-
下列对于元素周期表结构的叙述中,正确的是
A.7个横行代表7个周期,18个纵行代表18个族
B.副族元素中没有非金属元素
C.除第一周期外,其他周期均有18种元素
D.碱金属元素是指ⅠA族的所有元素
难度: 简单查看答案及解析
-
碱金属元素及其单质从Li→Cs的性质递变规律正确的是
A.密度逐渐增大 B.熔沸点逐渐升高
C.金属性逐渐增强 D.还原性逐渐减弱
难度: 简单查看答案及解析
-
下列关于卤素性质的叙述中不正确的是( )
A.卤素单质的颜色按Cl2、Br2、I2的顺序逐渐变深
B.氯气易液化,溴单质易挥发,碘单质易升华
C.氯、溴、碘的原子半径或离子半径随电子层数的增多而增大
D.Cl2、Br2、I2的氧化性逐渐增强
难度: 中等查看答案及解析
-
下列说法正确的是
A.由非金属元素组成的化合物不一定是共价化合物
B.离子化合物中一定不存在共价键
C.共价化合物中可能含有离子键
D.非极性键只存在于双原子单质分子里
难度: 简单查看答案及解析
-
下列关于物质性质的比较,不正确的是
A.非金属性强弱:I>Br>Cl B.原子半径大小:Na>P>S
C.氧化性强弱:F2>Cl2>Br2 D.金属性强弱:Na>Mg>Al
难度: 简单查看答案及解析
-
下列说法正确的是
A.氯化铵固体受热分解和干冰升华均只需克服分子间作用力
B.NaF、H2SO4中所含化学键的类型相同
C.HCl气体溶于水和NaOH熔化破坏的化学键类型相同
D.I2、Br2、Cl2、F2的熔、沸点逐渐降低
难度: 简单查看答案及解析
-
原子序数依次增大的四种短周期元素X、Y、Z、W,其中X的最高正化合价与Z的相同,Z原子的最外层电子数是内层电子数的0.4倍,Y元素的周期序数等于族序数,W的最高价氧化物对应的水化物的浓溶液Q是实验室常用的气体干燥剂。下列说法错误的是
A.原子半径:Y>Z>W>X
B.简单气态氢化物的热稳定性:X>Z
C.Y最高价氧化物对应的水化物可以和Q反应
D.加热条件下Q可氧化X、Y、Z的单质
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
原子半径(×10-10m)
1.86
0.99
1.43
1.60
0.75
0.74
主要
化合价
最高正价
+1
+7
+3
+2
+5
—
最低负价
—
-1
—
—
-3
-2
有关X、Y、Z、M、R和Q的下列说法正确的是( )
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,Z最剧烈
D.Y的氢化物的水溶液可用于蚀刻玻璃
难度: 中等查看答案及解析
-
已知空气—锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
难度: 简单查看答案及解析
-
下列是几种粒子的结构示意图,有关说法不正确的是
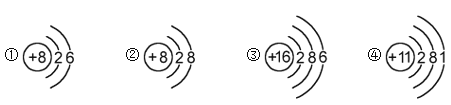
A.①和②属同种元素 B.②属于稀有气体元素
C.①和③的化学性质相似 D.④在反应中易失电子
难度: 简单查看答案及解析
-
下列说法正确的是
A.甲烷和乙烯均可使酸性KMnO4溶液褪色
B.纤维素、淀粉和蛋白质都是高分子化合物
C.煤的干馏和石油的分馏均属化学变化
D.葡萄糖和淀粉均能发生水解反应
难度: 中等查看答案及解析
-
下列关于海水资源综合利用的说法中,正确的是
A.只通过物理变化即可提取海水中的溴单质
B.海水蒸发制海盐的过程只发生化学变化
C.从海水中可以得到NaCl,可电解NaCl溶液制备Na
D.利用海水、铝、空气为能源的航标灯是将化学能转化为电能
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是( )
A.NH4Cl的电子式:
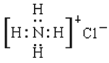 B.S2-的结构示意图:
B.S2-的结构示意图: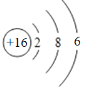
C.氨的电子式:
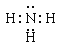 D.碳元素位于第2周期,VIA族
D.碳元素位于第2周期,VIA族难度: 简单查看答案及解析
-
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述错误的是( )
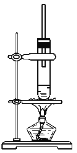
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.图中装置不能较好的控制温度为115~125 ℃
难度: 中等查看答案及解析
-
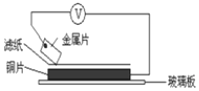
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓
 溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )
溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )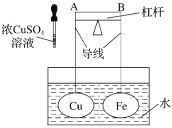
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
D.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
难度: 中等查看答案及解析
-
在2A(g)+B(g)
 3C(g)+4D(g)反应中,下列表示该反应速率最快的是( )
3C(g)+4D(g)反应中,下列表示该反应速率最快的是( )A. v(A)=0.5 mol/(L·min) B. v(B)=0.4 mol/(L·min)
C. v(C)=1.5×10-2mol/(L·s) D. v(D)=1.0mol/(L·min)
难度: 简单查看答案及解析
-
下图所示各种装置中能构成原电池的是
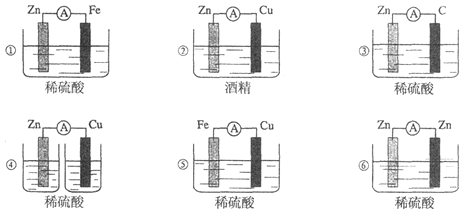
A.①②③ B.④⑤⑥ C.①③⑤ D.②④⑥
难度: 中等查看答案及解析
-
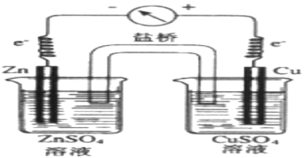
关于下图所示的原电池,下列说法正确的是
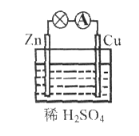
A. Cu为正极发生氧化反应
B. 负极反应为Zn-2e-===Zn2+
C. 电子由铜片通过导线流向锌片
D. 该装置能将电能转化为化学能
难度: 简单查看答案及解析
-
在容积可变的密闭容器中,2molN2和8molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于( )
A.5% B.10%
C.15% D.20%
难度: 中等查看答案及解析
-
证明可逆反应N2(g)+3H2(g)
 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )①6个N—H键形成的同时,有3个H—H键断裂;②3个H—H键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,密度保持不变;⑦3v(N2)正 =v(H2)逆;⑧容器内A、B、C、D四者共存 ⑨NH3的生成速率与分解速率相等; ⑩A 、B、C的分子数目比为1:3:2。
A.全部 B.①③④⑤⑧ C.②③④⑤⑦⑨ D.①③⑤⑥⑦⑩
难度: 中等查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
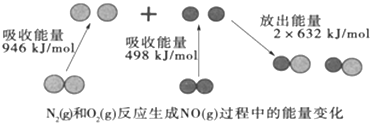
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
C.在1 L的容器中发生反应,10 min内 N2减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol·
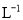 •
•
D.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
难度: 中等查看答案及解析
-
某温度下,在一固定容积的容器中进行反应:SO3(g)+NO(g)
 NO2(g)+SO2(g),下列情况一定能说明已经达到化学平衡状态的是
NO2(g)+SO2(g),下列情况一定能说明已经达到化学平衡状态的是A. 气体的密度不再随时间而改变
B. 体系总质量不再随时间而改变
C. NO(g)和NO2(g)的生成速率相同
D. SO3(g)和NO(g)的浓度比为1:1
难度: 简单查看答案及解析
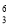 Li、②
Li、②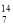 N、③
N、③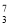 Li、④
Li、④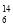 C几种核素中:
C几种核素中: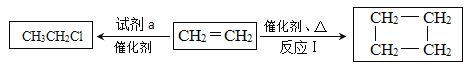
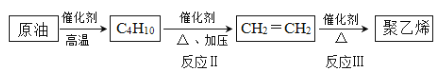
 xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。