-
化学与生活密切相关。下列说法错误的是
A. 明矾电离出的Al3+具有吸附性,可用作净水剂
B. 漂白粉可用于生活用水的消毒
C. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D. 碳酸钠可用于去除餐具的油污
难度: 中等查看答案及解析
-
徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。下列说法正确的是( )
A.H2O2分子中的O为sp2杂化 B.CO2 分子中C原子为sp杂化
C.BF3分子中的B原子sp3杂化 D.CH3COOH分子中C原子均为sp2杂化
难度: 中等查看答案及解析
-
判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定能自发进行的是
A.ΔH<0,ΔS>0 B.ΔH>0,ΔS>0 C.ΔH<0,ΔS<0 D.ΔH>0,ΔS<0
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.3p2表示3p能级有两个轨道
C.处于最低能量状态的原子叫做基态原子
D.同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 中等查看答案及解析
-
下列元素性质的递变规律正确的是
A.原子半径: C<N<S B.第一电离能:C<O<N
C.最高价氧化物的水化物的碱性:Na<Mg<Al D.与氢气化合的难易程度:N<O<S
难度: 中等查看答案及解析
-
下列说法正确的是
A.原子核外电子排布式为1s2的原子与核外电子排布式为1s2s2的原子化学性质相似
B.Fe3+的最外层电子排布式为3s23p63d5
C.基态铜原子的最外层的电子排布图:

D.电负性最大的非金属元素形成的含氧酸的酸性最强
难度: 中等查看答案及解析
-
下列描述正确的是
A.CS2为V形极性分子
B.C2H2分子中σ键与π键的数目比为1:1
C.当中心离子的配位数为6时,配离子常呈八面体结构
D.水加热到很高温度都难分解是因水分子间存在氢键
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1367.0kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=+57.3kJ·mol-1(中和热)
C.S(s)+O2(g)=SO2(g) ΔH=-296.8kJ·mol-1(反应热)
D.2NO2=O2+2NO ΔH=+116.2kJ·mol-1(反应热)
难度: 中等查看答案及解析
-
pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是
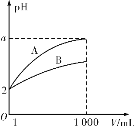
A.稀释前,A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.稀释导致B酸的电离程度减小
难度: 中等查看答案及解析
-
常温时,向20mL0.1mol/L的CH3COOH溶液中滴加0.1mol/L的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示,下列说法正确的是

A.a点溶液中c(CH3COO-)<c(Na+)
B.图中四点处水的电离程度最大的点为:b点
C.加入NaOH溶液过程中,
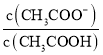 先增大后减小
先增大后减小D.CH3COOH的电离平衡常数Ka约为105
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
 CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是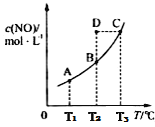
A. 该反应正反应的△H<0
B. 若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B)
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB
难度: 困难查看答案及解析
-
一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g)
 xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是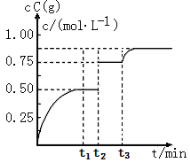
A.t2 时刻改变的条件是使用催化剂
B.t3时刻v(逆)可能小于t2 时刻v(逆)
C.t3时刻改变的条件一定是增大反应物的浓度
D.t1~t2、t2~t3平衡常数均为0.25
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 用0.2000 mol•L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol•L-1),当pH=7时,溶液中的酸恰好完全中和
D. 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:④>①>②>③
难度: 困难查看答案及解析
-
已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A.只有AgBr沉淀生成 B.AgCl与AgBr沉淀等量生成
C.AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D.AgCl与AgBr沉淀都有,但以AgBr沉淀为主
难度: 中等查看答案及解析
-
一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2—
下列说法正确的是
A.随pH的升高,碳钢腐蚀速率逐渐加快
B.pH<4,发生析氢腐蚀
C.pH为14,其负极反应为2H2O+Fe-3e-=FeO2-+4H+
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会加快
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
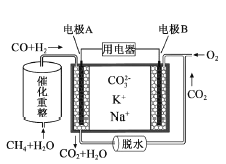
A.电极B上发生的电极反应为:O2+2CO2+4e-=2

B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,
 向电极A移动,电子由A极经电解质流向B极
向电极A移动,电子由A极经电解质流向B极D.反应CH4+H2O
 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子难度: 困难查看答案及解析
 2NO2。
2NO2。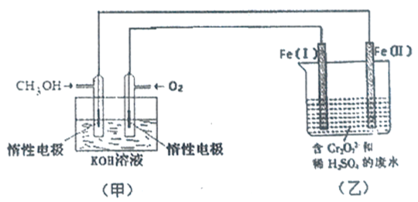
 废水,如上图所示。
废水,如上图所示。 Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Kgp=c(Cr3+).c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______________。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Kgp=c(Cr3+).c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______________。