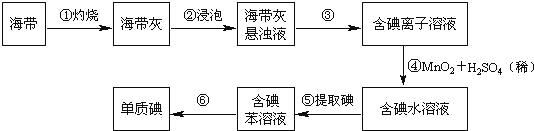
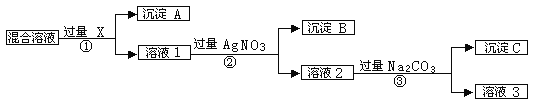
-
若NA代表阿伏加德罗常数,下列说法正确的是( )
A. 1个标准大气压,20℃下11.2LN2含有的分子数为0.5NA
B. 4℃时9mL水和标准状况下11.2L氮气含有相同的分子数
C. 同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
D. 0℃、1.01×104Pa时,11.2L氧气所含的原子数目为NA
难度: 中等查看答案及解析
-
在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72-和Pb2+,若生成3mol Cr2O72-则反应所需PbO2的物质的量为
A. 7.5mol B. 3mol C. 9mol D. 6mol
难度: 简单查看答案及解析
-
已知Mn2O7x-与S2-在酸性溶液中能发生反应:Mn2O7x-+3S2-+14H+=2Mn3++3S↓+7H2O。则Mn2O7x-中Mn元素的化合价是( )
A. +2 B. +4 C. +3 D. +6
难度: 简单查看答案及解析
-
下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
A.实验剩余的药品不能放回原试剂瓶
B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查
D.滴管不能交叉使用
难度: 简单查看答案及解析
-
不能用胶体的知识解释的现象是
A.豆浆中加入石膏做豆腐
B.一支钢笔使用两种不同牌号的墨水,易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在海水与河水交界处,易形成三角洲
难度: 简单查看答案及解析
-
下列操作不能达到目的的是
选项
目的
操作
A.
配制100 mL 1.0 mol/L CuSO4溶液
将25 g CuSO4·5H2O溶于100 mL蒸馏水中
B.
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C.
在溶液中将MnO4-完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D.
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
完成下列实验所需选择的装置或仪器都正确的是( )
A.
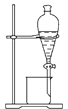 分离植物油和氯化钠溶液
分离植物油和氯化钠溶液B.
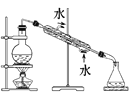 除去氯化钠晶体中混有的氯化钾晶体
除去氯化钠晶体中混有的氯化钾晶体C.
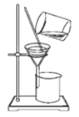 分离CCl4中的Br2
分离CCl4中的Br2D.
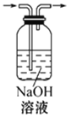 除去CO2气体中的HCl气体
除去CO2气体中的HCl气体难度: 简单查看答案及解析
-
下列实验方法或实验操作不正确的是
①在制取氧气中排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
③用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
④进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑤酒精着火时可用湿抹布或沙子扑灭
A.① B.②④ C.②④⑤ D.③④⑤
难度: 简单查看答案及解析
-
2.16 g X2O5中含有0.1 mol氧原子,则X的相对原子质量为
A.21.6 B.28 C.14 D.31
难度: 简单查看答案及解析
-
设阿伏伽德罗常数的符号为NA,标准状况下某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积(L)是
A.
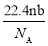 B.
B.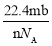 C.
C.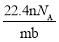 D.
D.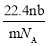
难度: 中等查看答案及解析
-
下列两种气体的分子数一定相等的是 ( )
A.质量相等密度不等的NO和C2H6 B.等体积不等密度的CO和C2H4
C.等温等体积的O3和N2 D.等压等体积的N2和CO2
难度: 困难查看答案及解析
-
下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-浓度相等的是( )
A.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
C.25 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的FeCl3溶液
难度: 中等查看答案及解析
-
实验中需2mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3·10H2O 的质量分别是( )
A.1000mL,212g B.950mL,543.4g C.950mL,201.4g D.1000mL,572g
难度: 简单查看答案及解析
-
把500mL含有BaCl2和KCl的混合溶液分成两等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.2(b-2a)mol·L-1 B.2(2a-b)mol·L-1
C.4(b-a)mol·L-1 D.4(b-2a)mol·L-1
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为
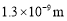 )恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列关于“钻酞菁”分子的说法中正确的是( )
)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列关于“钻酞菁”分子的说法中正确的是( )A.在水中形成的分散系能产生丁达尔效应
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.分子直径比钠离子小
D.在水中所形成的分散系属于悬浊液
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是
A.HNO3 B.Cl2 C.NH4NO3 D.SO2
难度: 简单查看答案及解析
-
下列物质中,能够导电的电解质是
A.Cu丝 B.熔融的MgCl2 C.NaCl溶液 D.液态HCl
难度: 简单查看答案及解析
-
能用H++OH-=H2O表示的是
A.澄清石灰水和稀盐酸的反应 B.Ba(OH)2溶液和稀H2SO4的反应
C.NaOH溶液和醋酸的反应 D.氨水和稀H2SO4的反应
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A.氢氧化钡溶液中加少量小苏打:Ba2++2OH-+2
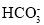 =BaCO3↓+
=BaCO3↓+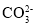 +2H2O
+2H2OB.向稀氨水中加稀盐酸:NH3·H2O+H+=
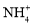 +H2O
+H2OC.少量氢氧化钠与氢硫酸反应:OH-+H2S=HS-+H2O
D.标准状况下2.24LCO2通入1mol/L100mLNaOH溶液中:CO2+OH-=
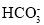
难度: 中等查看答案及解析
-
某无色透明的溶液中,能大量共存的离子组是
A.Na+、H+、
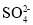 、
、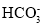 B.Cu2+、K+、
B.Cu2+、K+、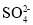 、
、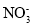
C.Na+、K+、Cl-、
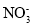 D.
D.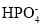 、K+、
、K+、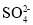 、OH-
、OH-难度: 简单查看答案及解析
-
吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3在人体中的作用是( )
A.作氧化剂 B.作还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂又不作还原剂
难度: 简单查看答案及解析
-
下列变化必须加入氧化剂才能发生的是
A.Cu2+→Cu B.Cl-→Cl2 C.H2SO4→SO2 D.CO2→CO32-
难度: 简单查看答案及解析
-
在6KOH+3Cl2==KClO3+5KCl+3H2O的反应中,下列说法中正确的是
A.KCl是还原产物,KClO3是氧化产物
B.Cl2是氧化剂,KOH是还原剂
C.KOH是氧化剂,Cl2是还原剂
D.被氧化的氯原子与被还原的氯原子数之比为5∶1
难度: 简单查看答案及解析
-
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-;
③2B-+Z2=B2+2Z-。由此推断下列说法正确的是
A.反应Z2+2A2+=2A3++2Z-可以进行
B.Z元素在①、③反应中均被还原
C.氧化性由强到弱的顺序是:XO4-、Z2、A3+、B2、
D.还原性由强到弱的顺序是:Z-、B-、A2+、X2+
难度: 中等查看答案及解析