-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
关于元素周期表的下列叙述,错误的是
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.在周期表中,把电子层数相同的元素排成一横行,称为一周期
C.元素周期表中,总共有18个纵行,18个族
D.第IA族的元素又称为碱金属元素(除了H),第ⅦA族的元素又称为卤族元素
难度: 简单查看答案及解析
-
下列叙述正确的是( )
①两种原子构成的分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦ B.只有①⑦ C.只有⑦ D.只有①⑤⑦
难度: 简单查看答案及解析
-
对于第三周期从左到右的主族元素,下列说法中不正确的是:
A.原子半径逐渐减小 B.电子层数逐渐增多
C.最高正化合价逐渐增大 D.元素的非金属性逐渐增强
难度: 简单查看答案及解析
-
A、B两元素原子电子层数相同,如果A原子半径比B大,则下列判断正确的是( )
A.两元素形成的最高价氧化物对应的水化物的酸性应是A强于B
B.A的气态氢化物比B的气态氢化物稳定
C.A的阴离子比B的阴离子还原性弱
D.A的金属性比B的金属性强
难度: 简单查看答案及解析
-
某原子的原子结构示意图
 ,该元素在周期表中的位置为( )
,该元素在周期表中的位置为( )A.第三周期,ⅤA族 B.第五周期,ⅢB族
C.第三周期,ⅤB族 D.第五周期,ⅢA族
难度: 简单查看答案及解析
-
下列物质中,既含离子键又含非极性共价键的是( )
A.NaOH B.Na2O2 C.CaCl2 D.H2O
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸的反应 B.氢氧化钡晶体与氯化铵晶体的反应
C.甲烷在氧气中的燃烧反应 D.灼热的碳与二氧化碳的反应
难度: 中等查看答案及解析
-
反应4CO+2NO2
 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是A.v(CO)=1.5 mol·L-1·min-1 B.v(NO2)=0.7 mol·L-1·min-1
C.v(N2)=0.4 mol·L-1·min-1 D.v(CO2)=1.1 mol·L-1·min-1
难度: 中等查看答案及解析
-
与铵根离子(
 )具有相同数目的电子的分子是( )
)具有相同数目的电子的分子是( )A.CH4 B.OH- C.NO D.H3O+
难度: 简单查看答案及解析
-
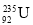 是重要的核工业原料,它的浓缩一直被国际社会所关注。有关
是重要的核工业原料,它的浓缩一直被国际社会所关注。有关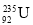 的说法正确的是( )
的说法正确的是( )A.
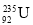 原子核中含有92个中子 B.
原子核中含有92个中子 B.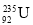 原子核外有143个电子
原子核外有143个电子C.
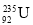 与
与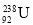 互为同位素 D.
互为同位素 D.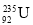 与
与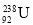 为同一核素
为同一核素难度: 简单查看答案及解析
-
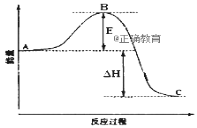
1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
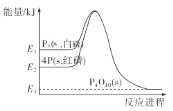
A. P4(s,白磷)=4P(s,红磷) ΔH>0
B. 以上变化中,白磷和红磷所需活化能相等
C. 白磷比红磷稳定
D. 红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
难度: 困难查看答案及解析
-
下列各组顺序排列不正确的是 ( )
A.热稳定性:HCl>H2S>PH3 B.离子半径:Na+>Mg2+>O2–
C.酸性强弱:H2SO4>H3PO4>H2SiO3 D.碱性强弱:KOH>Mg(OH)2>Al(OH)3
难度: 简单查看答案及解析
-
反应N2(g)+3H2(g)⇌2NH3(g)经过一段时间后,NH3的浓度增加了0.8 mol·L-1,在此段时间内用H2表示的平均反应速率为0.4 mol·L-1·s-1,则此段时间是( )
A.2 s B.20 s C.3 s D.1.33 s
难度: 简单查看答案及解析
-
2016年IUPAC命名117号元素为Ts(中文名“
 ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是
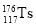
难度: 简单查看答案及解析
-
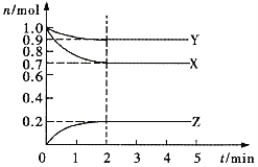
反应4A(g)+5B(g)=4C(g)+6D(g),在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.30mol。下列叙述正确的是( )
A.容器中含D物质的量至少为0.45mol
B.A的平均反应速率是
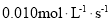
C.容器中A、B、C、D的物质的量之比一定是4:5:4:6
D.容器中A的物质的量一定增加了0.30mol
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,则反应物总能量>生成物总能量
B.相同条件下,如果1mol氢原子所具有的能量为E1,1 mol氢分子的能量为E2,则2E1=E2
C.101 kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ·mol-1,则H2的燃烧热为-572 kJ·mol-1
D.H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3kJ的热量
难度: 中等查看答案及解析
-
如图是元素周期表的一部分,下列说法中正确的是( )
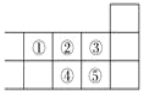
A.元素②位于第三周期ⅤIA族
B.元素④的原子序数比元素②的大8
C.元素①、②、③原子最外层电子数之和为20
D.元素的最高正化合价:③=⑤
难度: 简单查看答案及解析
-
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1mol N—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是( )

A.N4属于一种新型化合物
B.N4与N2互为同位素
C.N4沸点比P4(白磷)高
D.1mol N4气体转变为N2将放出882kJ热量
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法正确的是( )
A.原子半径:X>Y>W>Z
B.W和X组成的化合物一定是碱性氧化物
C.Z对应的气态氢化物中所有原子均达到8电子稳定结构
D.向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
难度: 中等查看答案及解析

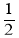 O2(g)=CO2(g) ∆H=–283.0 kJ/mol
O2(g)=CO2(g) ∆H=–283.0 kJ/mol