-
垃圾分类并回收利用,可以节约自然资源,符合可持续发展的要求。与食用油桶对应的垃圾分类标志是
A.
 可回收物 B.
可回收物 B. 其他垃圾
其他垃圾C.
 厨余垃圾 D.
厨余垃圾 D. 有害垃圾
有害垃圾难度: 简单查看答案及解析
-
CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
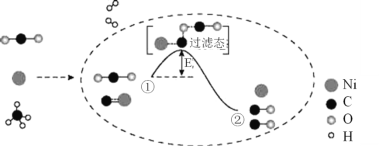
下列说法中不正确的是( )。
A.Ni是该反应的催化剂
B.过程①→②既有碳氧键的断裂,又有碳氧键的形成
C.过程①→②是吸热反应
D.反应的总化学方程式可表示为:CH4 +CO2
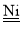 2CO+2H2
2CO+2H2难度: 中等查看答案及解析
-
科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
难度: 中等查看答案及解析
-
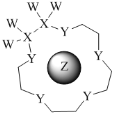
某有机物的结构简式如图所示,下列有关该有机物的说法不正确的是( )
A.苯环上的一氯代物有3种
B.含有2种官能团
C.分子中的所有碳原子一定共面
D.能发生氧化反应、取代反应、还原反应
难度: 中等查看答案及解析
-
下列实验中,能达到相应实验目的的是( )
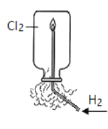
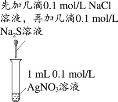
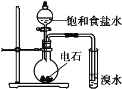
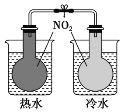
A.H2在Cl2中燃烧
B.证明氯化银溶
解度大于硫化银
C.证明乙炔可使溴水褪色
D.验证温度对平衡移动的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
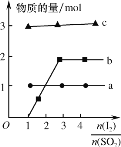
某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号
①
②
③
装置


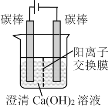
现象
小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化
两极均产生气泡,溶液无明显变化
两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
难度: 中等查看答案及解析
-
用亚硫酸盐(X)吸收烟气中的SO2。已知吸收过程中含硫组分物质的量分数(δ)与溶液pH的变化关系如下图所示。下列说法中不正确的是
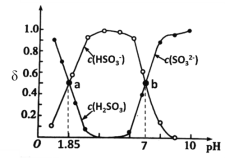
A.若X为Na2SO3,当吸收液pH=1.85时:c(Na+)=c(
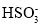 )+c(H2SO3)
)+c(H2SO3)B.若X为Na2SO3,当吸收液呈中性时:2c(
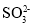 )+c(
)+c(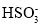 )=c(Na+)
)=c(Na+)C.若X为 (NH4)2SO3,(NH4)2SO3溶液呈碱性,说明水解程度:
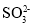 >
>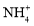
D.若X为 (NH4)2SO3,图中b点溶液中n(
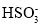 )∶n(
)∶n(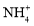 )= 1∶3
)= 1∶3难度: 困难查看答案及解析
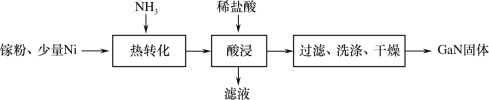
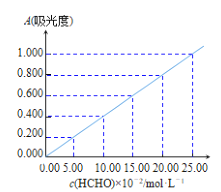
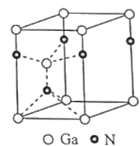
 ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。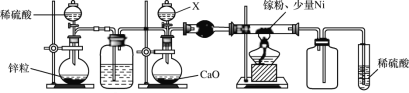
 GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生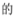 NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。 CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下: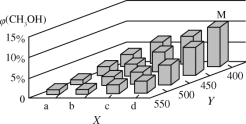
 +ClCH2CH2Cl
+ClCH2CH2Cl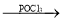
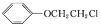 +HCl
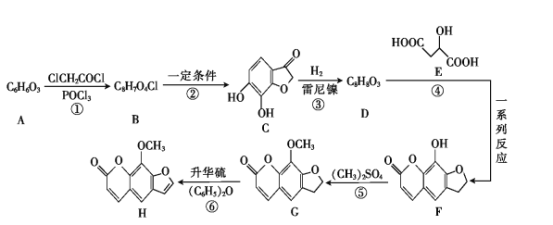
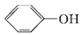
+HCl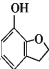 )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)