-
某化学反应其△H= —122 kJ·mol-1,∆S= —231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
难度: 简单查看答案及解析
-
现有强酸甲溶液的pH=1,强酸乙溶液的pH=2,则酸甲与酸乙的物质的量浓度之比不可能的是( )
A.2∶1 B.5∶1 C.10∶1 D.20∶1
难度: 简单查看答案及解析
-
T℃ 时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
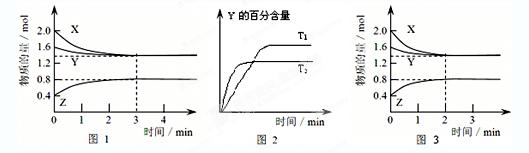
A.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
B. 容器中发生的反应可表示为:3X(g)+Y(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
难度: 简单查看答案及解析
-
在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可得到该物质固体的是( )
A.Al2(SO4)3 B.
C.
D.
难度: 简单查看答案及解析
-
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入的水和氢氧化钠溶液的体积比为( )
A.5:1 B.6: 1 C.10:1 D.11:1
难度: 简单查看答案及解析
-
常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( )
A.若c(OH-)>c(H+),则a=b B.若c(K+)>c(CH3COO-),则a>b
C.若c(OH-)=c(H+),则a>b D.若c(K+)<c(CH3COO-),则a<b
难度: 简单查看答案及解析
-
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=−67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=−57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V>20时, 溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
难度: 简单查看答案及解析
-
25℃时,amol.L-1一元酸HA与bmol.L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
A.a =b B.a>b C.c(A-) = c(Na+) D.c(A-)<c(Na+)
难度: 简单查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl−) + c(ClO−) + c(OH−)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3−) > c(CO32−) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl−) = c(NH4+) > c(OH−) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:
2c(H+) – 2c(OH−) = c(CH3COO−) – c(CH3COOH)
难度: 简单查看答案及解析
-
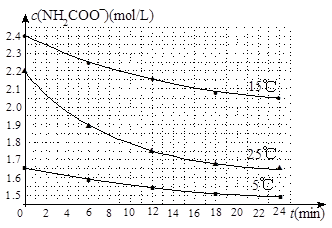
25℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度关系叙述正确的是
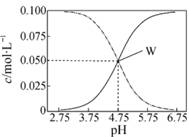
A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):
c(H+)=c(CH3COOH)+c(OH-)
难度: 简单查看答案及解析
-
下列电解质溶液的有关叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)= c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)= c(CH3COO-)
难度: 简单查看答案及解析
-
已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol∙L−1的一元酸HA与b mol∙L−1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a = b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=
mol∙L−1
D.混台溶液中,c(H+)+ c(B+) = c(OH-)+ c(A-)
难度: 简单查看答案及解析
-
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g)
H2O(l) 的ΔH = 40.69 kJ·mol-1
B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-) = 6.82 × 10-6
C.已知:
共价键
C-C
C=C
C-H
H-H
键能/ kJ·mol-1
348
610
413
436
则可以计算出反应
的ΔH为-384 kJ·mol-1
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
难度: 简单查看答案及解析
-
下列叙述正确的是
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
难度: 简单查看答案及解析
-
向10mL 0.1mol·L−1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B.x=10时,溶液中有NH4+、AlO2-、SO42-,且c(NH4+)>c(SO42-)
C.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)<c(AlO2-)
D.x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-) = c(Ba2+)
难度: 简单查看答案及解析
-
室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
A.若PH>7,则一定是C1V1=C2V2
B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-) +C(OH-)
C.当PH=7时,若V1=V2,一定是C2>C1
D.若V1=V2,C1=C2,则C(CH3COO-) +C(CH3COOH)=C(Na+)
难度: 简单查看答案及解析
-
已知反应:2CH3COCH3(l)
CH3COCH2COH(CH3)2(l)。 取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线 (Y-t)如下图所示。下列说法正确的是
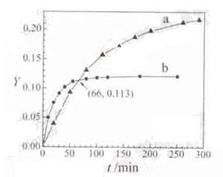
A.b代表0℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,H3COCH3的
>1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
=1
难度: 简单查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g) 、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
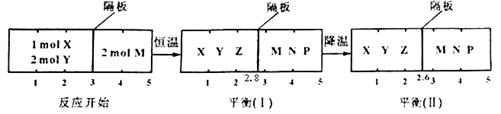
下列判断正确的是
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为
D. 在平衡(I)和平衡(II)中M的体积分数相等
难度: 简单查看答案及解析