-
升高温度,下列物理量的值一定增大的是( )
A.化学反应的焓变 B.化学平衡常数 C.反应物的转化率 D.弱酸的电离平衡常数
难度: 中等查看答案及解析
-
能源是可以直接或经转换提供人类所需的光、热、动力等任意形式能量的载能体资源。确切而简单地说,能源是自然界中能为人类提供某种形式能量的物质资源,人类的一切经济活动和生存都依赖于能源的供给。下列对能源的认识错误的是
A.阳光、风力、潮汐、流水都属于能源
B.氢气、太阳能、地热能都属于绿色能源
C.天然气、乙醇、氢气都属于可再生能源
D.煤、石油、太阳能都属于一次能源
难度: 简单查看答案及解析
-
污染源排人大气中的碳氢化合物和氮氧化物等一次污染物在阳光作用下发生光化学反应生成二次污染物,该二次污染物与一-次污染物混合所形成的有害浅蓝色烟雾则为光化学烟雾(如图所示)。下 列叙述错误的是
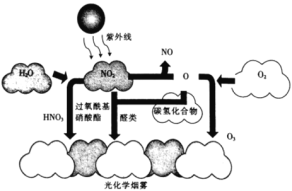
A.光化学烟雾是一种具有强氧化性和刺激性的烟雾
B.光化学烟雾的分散质只有一种
C.“O”是产生光化学烟雾的一种中间体
D.汽车尾气的大量排放可导致光化学烟雾的形成
难度: 中等查看答案及解析
-
溴与氢气在一定条件下反应的热化学方程式如下:①Br2(g) + H2(g)⇌2HBr(g) △H=-Q1 kJ/mol;②Br2(l)+H2(g)⇌2HBr (g) △H =-Q2 kJ/mo1。(Q1、Q2均大于零)下列说法正确的是
A.Q1<Q2
B.向1 mol Br2(g)中加入1 mol H2(g)在该条件下充分反应,放出Q1 kJ热量
C.相同条件下,Cl2(g) +H2(g)⇌2HCl(g) △H>-Q1 kJ/mol
D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
难度: 中等查看答案及解析
-
下列各项操作中,会出现“先生成沉淀,后沉淀溶解”现象的是
A.向偏铝酸钠溶液中滴加盐酸直至盐酸过量
B.向饱和NaHCO3溶液中通入CO2气体直至CO2过量
C.向Na2SiO3溶液中通入HCl气体直至HCl过量
D.向Ba(NO3)2溶液中通入SO2气体直至SO2过量
难度: 中等查看答案及解析
-
羧酸和醇发生酯化反应的过程如下图所示:
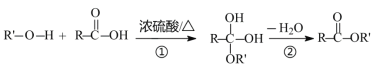
可见酯化反应不是简单的取代反应,步骤①和②的有机反应类型为( )
A.①为加成反应,②为消去反应 B.①为氧化反应,②为还原反应
C.①为取代反应,②为消去反应 D.①为加成反应,②为氧化反应
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物。由此可知,下列说法正确的是( )

A.X形成的单核阴离子的还原性大于Y形成的单核阴离子的还原性
B.Y、Z的氧化物对应水化物的酸性一定是Y的强于Z的
C.X、Y、Z的最简单氢化物中稳定性最弱的是Y的氢化物
D.Z的单质在化学反应中只能表现出氧化性
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.3.2 g SO2中含有的电子总数与等质量的N2中含有的电子总数不相等
B.标准状况下,22.4 L HF中含有NA个分子
C.室温下,1 L pH=12的Ba(OH)2溶液中含有OH-的数目为0.01NA
D.3.0 g C2H6中含有共价键的数目为0.6NA
难度: 中等查看答案及解析
-
2020年在东非和南亚地区爆发了一场几十年未见的大规模蝗灾。蝗虫分泌的一种信息素的.结构如图,下列关于该物质的说法中正确的是
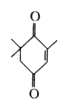
A.分子式为C9H12O2 B.分子中所有碳原子位于同一平面
C.不能使酸性KMnO4溶液褪色 D.与
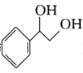 互为同分异构体
互为同分异构体难度: 中等查看答案及解析
-
FeCl3与H2O制得胶体的胶团结构为{ [Fe(OH)3]m·nFeO+ (n-x)Cl- }x+·x Cl- (如图)。下列说法正确的是
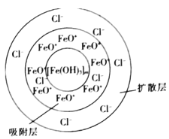
A.Fe(OH)3胶体带正电
B.胶体粒子的直径介于1~100 nm之间
C.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为6.02×1022
D.在U形管中注入Fe(OH)3胶体,插入石墨电极通电,阳极周围颜色加深
难度: 中等查看答案及解析
-
下列离子组在指定溶液中能大量共存的是
A.FeCl2溶液中:H+、
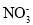 、
、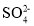
B.pH=1的溶液中:K+、Br-、ClO-
C.KI溶液中:Mg2+、Fe3+ 、Cl-
D.中性溶液中:
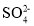 、Cl-、Na+
、Cl-、Na+难度: 中等查看答案及解析
-
由SO2催化氧化制取SO3的装置如图所示,下列说法错误的是
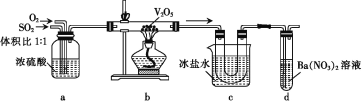
A.装置a可干燥并混合SO2和O2
B.装置b中流出的气体有SO2、SO3及O2
C.装置c中U形管内壁上有白色固体
D.装置d中有白色沉淀,说明通入d的气体中含SO3
难度: 中等查看答案及解析
-
某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )
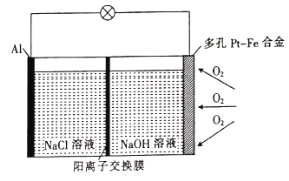
A.多孔Pt—Fe合金电极有利于吸附O2
B.负极的电极反应式为
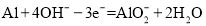
C.若反应中消耗5.4 g Al,则消耗3.36 L O2
D.当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
难度: 简单查看答案及解析
-
25 ℃时,向20 mL0.1 mol/L H2A溶液中滴加0.1 mol/L 的NaOH溶液,(忽略反应前后溶液体积变化)原溶液中部分粒子的物质的量随滴入NaOH溶液体积的变化如图所示。下列说法不正确的是
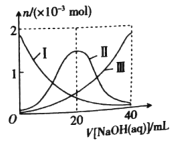
A.II表示的是HA-的物质的量的变化曲线
B.NaHA水溶液显碱性
C.
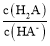 的值随着V[NaOH(aq) ]的增大而减小
的值随着V[NaOH(aq) ]的增大而减小D.当V[NaOH(aq)] = 20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.05 mol/L
难度: 困难查看答案及解析
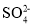 中,中心原子的轨道杂化类型为___________________。
中,中心原子的轨道杂化类型为___________________。
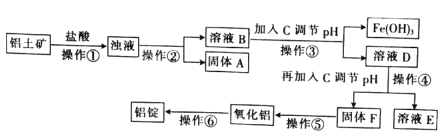
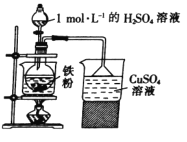
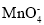 +5Fe2+ +8H+=Mn2++5Fe3++4H2O。现称取3. 30 g (NH4)2Fe(SO4)2·6H2O (相对分子质量为392)产品(杂质只有FeSO4·7H2O,相对分子质量为278)溶于稀硫酸中,然后用0.10 mol/L的酸性高锰酸钾溶液滴定,达到终点时消耗了18. 00 mL酸性高锰酸钾溶液。
+5Fe2+ +8H+=Mn2++5Fe3++4H2O。现称取3. 30 g (NH4)2Fe(SO4)2·6H2O (相对分子质量为392)产品(杂质只有FeSO4·7H2O,相对分子质量为278)溶于稀硫酸中,然后用0.10 mol/L的酸性高锰酸钾溶液滴定,达到终点时消耗了18. 00 mL酸性高锰酸钾溶液。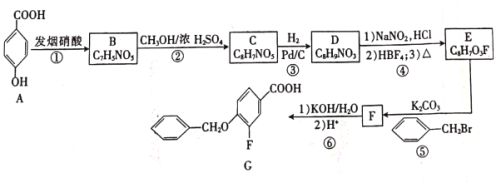
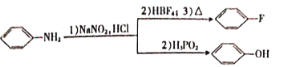
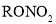 )的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。
)的X有______种,且核磁共振氢谱有3组峰,峰面积之比为6∶2∶1的结构简式为______(只写一种)。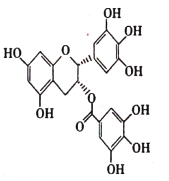
 溶液发生显色反应
溶液发生显色反应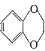 )是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。
)是制备原发性高血压药物多沙唑嗪的中间体,设计以苯酚和1,2—二溴乙烷为原料制备1,4—苯并二恶烷的合成路线(无机试剂任用)____________________。