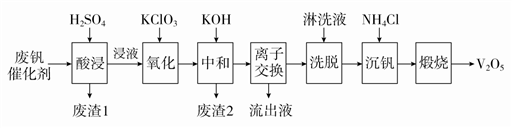
-
常温下, 下列各组物质中,Y既能与X反应又能与Z反应的是( )
X
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
稀盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A. ①③ B. ①④ C. ②④ D. ②③
难度: 中等查看答案及解析
-
减少酸雨产生的途径可采取下列中的哪些措施:①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气、甲醇等⑤开发新能源( )
A. ①②③ B. ②③④⑤ C. ①③⑤ D. ①③④⑤
难度: 简单查看答案及解析
-
仅通过物理方法就能从海水中获得的物质是
A. 钠、镁 B. 溴、碘 C. 食盐、淡水 D. 氯气、烧碱
难度: 简单查看答案及解析
-
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划分为同一类物质,下列分类标准正确的是
①钠的化合物 ②能与硝酸反应的物质 ③电解质 ④钠盐 ⑤钠的含氧化合物
A. ①④ B. ③④ C. ②⑤ D. ①③
难度: 简单查看答案及解析
-
关于一些重要的化学概念有下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;
②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;
④置换反应都属于离子反应。其中正确的是( )
A. ①④ B. ①② C. ②④ D. ①③
难度: 中等查看答案及解析
-
在物质分类中,前者包括后者的是( )
A. 氧化物、化合物 B. 溶液、分散系 C. 溶液、胶体 D. 化合物、电解质
难度: 简单查看答案及解析
-
下列变化中的酸只表现出酸性的是( )
A. 浓硫酸与蔗糖混合 B. 浓硝酸与铜反应
C. 稀硫酸与BaCl2溶液混合 D. 盐酸与Na2CO3溶液混合
难度: 简单查看答案及解析
-
钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;
④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。
其中正确的一组是( )
A. ②③④⑤⑥ B. 全部 C. ①③④⑤⑥ D. ①③④⑥
难度: 简单查看答案及解析
-
下列说法正确的是
A. 阳离子只有氧化性,阴离子只有还原性
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 要实现Fe2+→Fe3+的转化,必须加入氧化剂
难度: 中等查看答案及解析
-
已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是
A. A13+、CH3COO-、C1- B. Na+、NH4+、C1-
C. Mg2+、C1-、Fe2+ D. Mg2+、Ba2+、Br-
难度: 中等查看答案及解析
-
2013年10月14日,“Health Day News”报道:双酚基丙烷(BPA,分子式为C15H16O2)可 能降低男性及女性的生育能力。下列有关判断不正确的是( )
A. BPA的摩尔质量是228 g·mol-1 B. 1 mol BPA中含有6.02×1023个分子
C. BPA属于有机化合物 D. 1 mol BPA在标准状况下的体积约为22.4 L
难度: 简单查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化工生产过程中,未涉及氧化还原反应的是( )
A. 海带提碘 B. 氯碱工业
C. 氨碱法制碱 D. 海水提溴
难度: 简单查看答案及解析
-
下列物质分类的正确组合是( )
选项
混合物
纯净物
单质
电解质
A
盐酸
NaOH
石墨
K2SO4溶液
B
空气
Fe(OH)3胶体
铁
Na2CO3
C
CuSO4·5H2O
CaCl2
水银
铜
D
氯水
KNO3晶体
O3
NaCl
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应中的氨与反应4NH3+5O2===4NO+6H2O中的氨作用相同的是( )
A. 2Na+2NH3===2NaNH2+H2↑
B. 2NH3+3CuO===3Cu+N2+3H2O
C. NH3+HNO3===NH4NO3
D. 3SiH4+4NH3===Si3N4+12H2
难度: 中等查看答案及解析
-
某溶液含有①NO
、②HCO
、③SO
、④CO
、⑤SO
等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )
A. ① B. ①⑤ C. ①④⑤ D. ①③④⑤
难度: 中等查看答案及解析
-
2015年春,雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测。下列有关说法正确的是( )
A. 臭氧的摩尔质量是48 g
B. 同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C. 16 g臭氧中含有6.02×1023个原子
D. 1.00 mol臭氧中含有电子总数为18×6.02×1023
难度: 简单查看答案及解析
-
把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,此时若滴
入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A. SO2 B. Fe2+ C. Fe3+ D. NO3-
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①过量Na2O2投入到FeCl2溶液中 ②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2SiO3溶液中通入过量CO2
⑤CaCl2与NaOH的混合溶液中通入过量CO2
A. 全部 B. ①⑤ C. ②③④ D. ②③④⑤
难度: 中等查看答案及解析
-
下列离子方程式或化学方程式正确的是( )
A. SO2通入少量NaClO溶液中:SO2+ClO-+H2O===SO42-+Cl-+2H+
B. 足量的SO2通入Na2CO3溶液中:CO32-+SO2===CO2+SO32-
C. 铁与硫混合加热:2Fe+3S
Fe2S3
D. 浓硫酸与FeS混合:FeS+H2SO4(浓)===FeSO4+H2S↑
难度: 中等查看答案及解析
-
在化学学科中经常使用下列物理量,其中跟阿伏加德罗常数(NA)无关的组合是( )
①相对原子质量(Mr) ②摩尔质量(M) ③原子半径(r) ④溶解度(S) ⑤物质的量(n)
⑥溶质的质量分数(w) ⑦气体摩尔体积(Vm)
A. ①③④⑥ B. ②④⑤ C. ①②③④ D. ⑤⑥⑦
难度: 中等查看答案及解析
-
下列实验操作过程能引起实验结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗
②用量筒量取5.0 mL溶液时,俯视读数
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等体积混合配制50%的硫酸溶液A. ①③ B. ①④ C. ②③ D. ②④
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 23g Na 与足量H2O反应完全后可生成NA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是( )
A. 碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
B. 将磁性氧化铁溶于盐酸:Fe3O4+8H+===2Fe2++Fe3++4H2O
C. 将金属铝加入NaOH溶液中:2Al+2OH-+2H2O===2AlO2—+3H2↑
D. 金属钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
难度: 简单查看答案及解析
-
下列有关物质性质的应用正确的是
A. 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液
B. 碳酸钠溶液显碱性,可用热的纯碱溶液除去金属器件表面油污
C. 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却
D. 铜的金属性比铁弱,可将海轮浸水部分镶上铜锭以减缓船体腐蚀
难度: 中等查看答案及解析
-
某溶液中含有较大量的Cl-、CO
、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A. ①②④②③ B. ④②①②③ C. ①②③②④ D. ④②③②①
难度: 中等查看答案及解析
-
将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水 ②品红溶液 ③酸性高锰酸钾溶液 ④硝酸钡溶液 ⑤含酚酞的氢氧化钠溶液
⑥氢硫酸 ⑦紫色石蕊试液 ⑧氯化铁溶液
A. ①⑤⑥④ B. ⑧②⑥⑤ C. ③⑦⑥⑤ D. ④②⑤①
难度: 中等查看答案及解析
-
用98%的浓硫酸(密度为1.84 g·cm-3)配制 250 mL浓度为0.5 mol·L-1的H2SO4溶液,选用的仪器正确的是( )
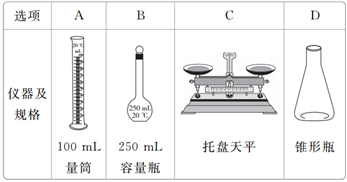
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于反应KMnO4+HCl(浓)——KCl+MnCl2+Cl2↑+H2O(未配平),若有0.1 mol KMnO4参加反应,下列说法正确的是( )
A. 生成0.5 mol Cl2 B. 转移0.5 mol电子
C. 参加反应的HCl为1.6 mol D. Cl2是还原产物
难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有100mL 3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A. 5.4g B. 3.6g C. 2.7g D. 1.8g
难度: 困难查看答案及解析