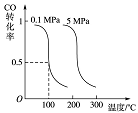
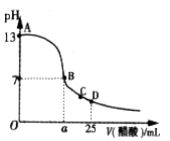
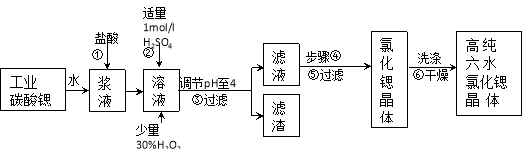
-
酸雨给人类带来了种种灾难,严重地威胁着地球生命生存的生态环境,下列有关减少或者防止酸雨形成的措施中可行的是
①将煤液化或气化,获得清洁燃料
②对含SO2、NO2等工业废气进行无害处理后,再排放到大气中
③人工收集雷电作用所产生的氮的氧化物
④飞机、汽车等交通工具采用新能源,比如氢能
A.①②④ B.①②③ C.①②③④ D.①③④
难度: 简单查看答案及解析
-
下表中关于物质分类的正确组合是
类别组合
酸性氧化物
碱性氧化物
电解质
强电解质
高分子物质
A
CO2
CuO
氨气
NH3·H2O
葡萄糖
B
SO3
Na2O
稀硫酸
NaOH
果糖
C
SO2
CaO
冰醋酸
KOH
纤维素
D
N2O5
Na2O2[
α-丙氨酸
Cu(OH)2
聚乙烯
难度: 中等查看答案及解析
-
常温下,下列各组离子或分子在指定溶液中能大量共存的是
A. pH=l的溶液中:Fe2+、Na+、SO42-、NO3-
B.水电离的c(H+)=l×l0-13mol/L的溶液中:NH4+、K+、Cl-、HCO3-
C. KMnO4溶液中:H+、Na+、SO42-、C2H5OH
D. 使甲基橙变红色的溶液中:NH4+、Al3+、NO3-、Cl-
难度: 中等查看答案及解析
-
设NA为的值。下列说法正确的是
A. 0.lmol过氧化钠中,阴阳离子总数为0.4 NA
B. 11.2L氯气通入足量的水中充分反应,转移的电子数目为0.5 NA
C. 42g乙烯与丙烯的混合气体含碳原子数目为3 NA
D. 1L 0.lmol/L氨水中,OH-数目为0.1 NA
难度: 中等查看答案及解析
-
利尿酸是奥运会禁止使用的兴奋剂之一,其结构简式如下图。下列有关利尿酸的说法中正确的是
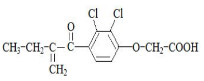
A. 分子式是C13H14O4Cl2
B. 1mol利尿酸最多能与5mol H2发生加成反应
C. 一定条件下能发生加聚、缩聚反应
D. 分子中所有碳原子不可能共平面
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子的物质的量浓度关系正确的是
A.0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-)
B.0.lmol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L
C.pH=11的NaOH溶液与pH =3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)> c(OH-)= c(H+)
D.浓度均为0.1 mol/L的 ① NH4Cl ②NH4Al(SO4)2 ③ NH4HCO3三种溶液,其中c(NH4+):③>①>②
难度: 困难查看答案及解析
-
在一定温度下,将6 mol CO2和8 mol H2充入2L恒容密闭容器中,发生反应:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
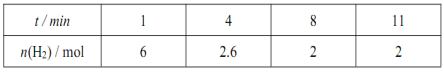
A.反应前4min的平均速率v(CO2)= 0.45 mol/(L.min)
B.达到平衡时,H2的转化率为25%
C.其他条件不变,升高温度,反应达到新平衡时CH3OH的体积分数增大
D.该温度下,该反应的平衡常数为0.5
难度: 困难查看答案及解析
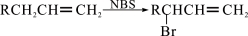 。
。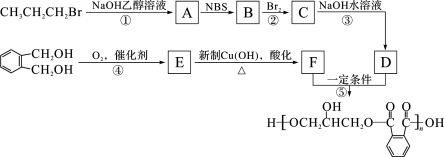
 的同分异构体中同时符合下列条件的芳香族化合物共有______________种。
的同分异构体中同时符合下列条件的芳香族化合物共有______________种。