-
在抗击“2019新型冠状病毒”的过程中,84消毒液、75%的乙醇溶液等消毒剂可有效灭活新型冠状病毒。下列有关说法正确的是
A.新型冠状病毒包含蛋白质,蛋白质属于天然高分子化合物
B.乙醇与甘油具有不同的官能团
C.居家常用的84消毒液与75%乙醇混合使用,乙醇可能将次氯酸钠氧化成氯气引起危险
D.大量饮用高度酒可以预防“新型冠状病毒”
难度: 简单查看答案及解析
-
日常生活中的下列做法,与调控化学反应速率无关的是
A.食品抽真空包装 B.用热水溶解蔗糖以加速溶解
C.在铁制品表面刷油漆 D.低温冷藏食品
难度: 简单查看答案及解析
-
由下列电极材料、稀硫酸组成的原电池工作时,下列说法中正确的是
A.在铁、铝、稀硫酸组成的原电池中,硫酸根离子向铁片移动
B.在锌、铜、稀硫酸组成的原电池中,电流由铜片通过导线流向锌片
C.在铁、铜、稀硫酸组成的原电池中,其负极反应式为Fe - 3e- = Fe3+
D.在铜、锌、稀硫酸组成的原电池中,是利用电能使锌与硫酸发生反应
难度: 中等查看答案及解析
-
对氧化铁与铝粉发生的“铝热反应”(装置如图)的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅资料得知:Al、A12O3、Fe、Fe2O3熔点数据如表,下列叙述正确的是
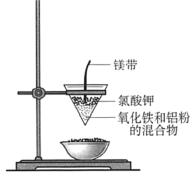
物质
Al
Al2O3
Fe
Fe2O3
熔点 /℃
660
2054
1535
1462
A.铝热剂特指铝和氧化铁的混合物
B.镁条和KClO3是铝热反应的催化剂
C.该反应所得熔融物熔点低于660℃
D.将少量该反应所得的熔融物溶于足量稀H2SO4,充分反应后,滴加KSCN溶液无明显现象,说明熔融物中无Fe2O3
难度: 中等查看答案及解析
-
下列说法正确的是
A.长周期均含18种元素
B.周期表中的第13列是第ⅢB族
C.同一主族的元素,从上到下,氢化物的沸点逐渐增大
D.半导体器件的研制开始于锗
难度: 简单查看答案及解析
-
已知某粒子A的结构示意图为:
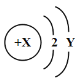 。下列说法正确的是
。下列说法正确的是A.当Y = 8时,该粒子为氖原子
B.当X - Y>2时,该粒子为阴离子
C.当Y = 7时,该元素的最高价氧化物对应水化物的化学式为HAO4
D.当X = 13时,该元素的氯化物属于共价化合物
难度: 简单查看答案及解析
-
下列反应既属于离子反应,又属于放热反应的是
A.锌粒与稀硫酸的反应
B.灼热的木炭与CO2的反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 中等查看答案及解析
-
化学上可用仪器观测特定核素在化学变化中的行踪来确定反应的原理。若用K35C1O3晶体和含有H35Cl的浓盐酸进行KClO3 + 6HC1(浓) = KCl + 3Cl2↑ + 3H2O反应的探究,下列说法不正确的是
A.1 mol H37Cl中所含的中子数为20NA
B.35C1、37Cl互为同位素
C.该反应既有离子键和共价键的断裂,又有离子键和共价键的形成
D.生成氯气的摩尔质量为71 g/mol
难度: 中等查看答案及解析
-
在一定温度下,在5 L恒容密闭容器中发生反应:X(g) +Y(g)⇌2Z(g),开始时加入3 mol X、4 mol Y、2 mol Z,反应过程中测定的数据如下表,下列说法正确的是
t /min
2
4
10
c(Y) / mol/L
0.5
0.3
a
A.2~4 min用X的浓度变化表示反应的平均速率0.1 mol/(L·s )
B.a可能为0.2
C.其他条件不变,若再充入1 mol Y化学反应速率会增大
D.其他条件不变,若将容器的体积变为3 L,化学反应速率不变
难度: 简单查看答案及解析
-
X、Y、Z、W为4种短周期元素,已知X、Y同周期且X最外层电子数与Z的内层电子数之和为8,Y2+、Z-、W+三种离子的电子层结构相同,下列叙述正确的是
A.原子序数:Z > Y B.离子半径:W > X
C.金属性:Y > W D.气态氢化物的稳定性:X <Z
难度: 困难查看答案及解析
-
某有机化合物的球棍模型如图所示,该有机物不可能发生的化学反应是
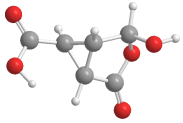
A.水解反应
B.加聚反应
C.酯化反应
D.氧化反应
难度: 中等查看答案及解析
-
垃圾分类是社会新风尚,新要求。下列说法正确的是
A.废弃的聚乙烯塑料属于可回收垃圾,能使酸性高锰酸钾溶液褪色
B.破损的玻璃属于其他垃圾,属于硅酸盐材料
C.废荧光灯管属于有害垃圾,不可用填埋法处理
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
难度: 简单查看答案及解析
-
少量乙酸乙酯分别与等体积的稀硫酸溶液和稀氢氧化钠溶液混合受热,充分反应后试管内的实验现象正确的是
稀硫酸
稀氢氧化钠溶液
①
②
③
④




A.①③
B.①④
C.②③
D.②④
难度: 简单查看答案及解析
-
以乙烯为原料经过一系列反应可生产抗新冠病毒消毒剂过氧乙酸(具有很强的氧化性和腐蚀性),其合成路线如图。下列说法不正确的是

A.A→B的反应类型是加成反应
B.C的分子式是C2H4O
C.浓过氧乙酸溶液中加入少许紫色石蕊试液,溶液最终为无色
D.过氧乙酸与乳酸(
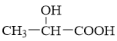 ),组成上相差一个CH2,故互为同系物
),组成上相差一个CH2,故互为同系物难度: 简单查看答案及解析
-
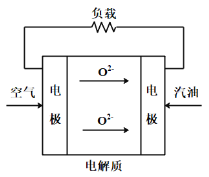
某汽油(主要成分是丁烷)燃料电池,放电时反应的化学方程式为:2C4H10+ 13O2= 8CO2+ 10H2O,下列说法不正确的是
A.其能量转换形式是将化学能直接转化为电能
B.提炼汽油的原料是石油,石油是一种不可再生能源
C.若负极上有32g O2参加反应,则反应过程中转移电子4mol e-
D.若电池的电解质是固体氧化物(在高温下能传导O2-),其工作原理如图:
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.足量Fe在1 mol Cl2中充分燃烧,转移2NA个电子
B.标准状况下,2.24 L Cl2通入足量水中发生反应转移电子数为0.1NA
C.40 mL 10 mol/L的浓硝酸与足量铜加热反应转移电子数为0.2NA
D.6.9 g的NO2与足量的水反应转移电子的数目为0.15NA
难度: 简单查看答案及解析

 表示第Ⅷ族的位置。
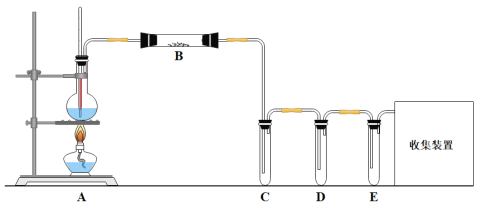
表示第Ⅷ族的位置。 CH2=CH2↑ +H2O,某校化学实验兴趣小组为验证实验室制备乙烯中含有水蒸气、SO2,同时收集少量乙烯,甲同学设计了如图所示的实验装置,按要求回答问题:
CH2=CH2↑ +H2O,某校化学实验兴趣小组为验证实验室制备乙烯中含有水蒸气、SO2,同时收集少量乙烯,甲同学设计了如图所示的实验装置,按要求回答问题: