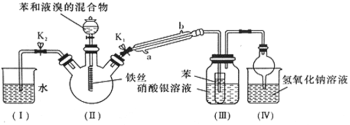
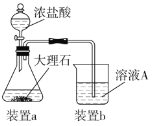
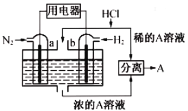
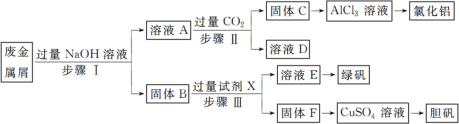-
化学与生活密切相关。下列相关说法正确的是
A.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
B.棉花、人造丝、蚕丝的主要成分都属于蛋白质
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果中的乙烯,可以实现水果保鲜的目的
D.食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物
难度: 中等查看答案及解析
-
下列表示反应中相关微粒的化学用语正确的是
A.NH4Cl的电子式:
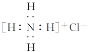 B.聚丙烯的结构简式:
B.聚丙烯的结构简式: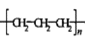
C.CCl4的比例模型:
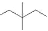
 D.乙烯的球棍模型:
D.乙烯的球棍模型: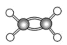
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L CH3CH2OH含有共价键数为0.8NA
B.密闭容器中0.2mol SO2和0.1mol O2充分反应,生成SO3的分子数为0.2NA
C.0.1 mol的甲基中,含有NA个电子
D.28 g的乙烯和环丙烷混合气体中所含原子总数为6NA
难度: 中等查看答案及解析
-
下列说法不正确的是
①有机物
 与甲烷是同系物
与甲烷是同系物②H2O与D2O互为同位素
③CH3COOCH2CH3和CH3CH2COOCH3是不同物质
④
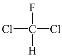 与
与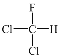 是同分异构体
是同分异构体⑤CH3CH2OH 和
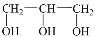 具有相同的官能团,互为同系物
具有相同的官能团,互为同系物⑥
 、
、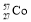 、
、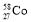 、
、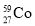 是同素异形体,其物理性质有差异,化学性质相同
是同素异形体,其物理性质有差异,化学性质相同A.②④⑤⑥ B.②③⑤⑥ C.①③⑤ D.全部
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是
选项
项目
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色、可溶于四氯化碳
B
乙醇与水都可与金属钠反应产生可燃性气体
乙醇分子中的羟基氢与水分子中的氢具有相同的活性
C
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D
将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味
乙醇已被铜氧化为乙醛
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某有机物的结构简式如图,下列说法正确的是
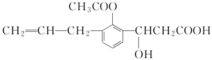
A.与足量H2充分反应,生成物的分子式为C14H18O5
B.能发生酯化反应,不能发生水解反应
C.能与O2在Cu做催化剂加热的条件下发生氧化反应生成醛
D.能被酸性重铬酸钾溶液氧化
难度: 中等查看答案及解析
-
“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是
A. 工业生产环氧乙烷:
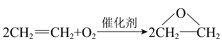
B. 水煤气合成甲醇:CO + 2H2催化剂CH3OH
C. 制取硫酸铜:Cu + 2H2SO4(浓)加热CuSO4 + SO2↑+ 2H2O
D. 合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OH Pd CH2=C(CH3)COOCH3
难度: 中等查看答案及解析
-
下列有机物的同分异构体数目最多的是
A.C6H14 B.C5H11Cl C.C4H10O D.C3H6Cl2
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述错误的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述错误的是A.高铁电池的负极材料是Zn
B.放电时正极附近溶液的碱性减弱
C.放电时每转移3 mol电子,正极有1mol K2FeO4被还原
D.放电时,正极发生还原反应
难度: 中等查看答案及解析
-
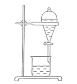
下列实验装置、试剂或操作正确的是
A.分离乙醇和乙酸:
B.除去甲烷中的乙烯:
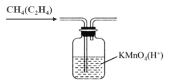
C.除去溴苯中的溴单质:
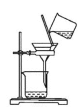
D.铝热反应:
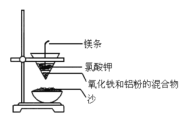
难度: 简单查看答案及解析
-
如图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中不正确的是
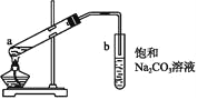
A.试管b中导气管下端管口不能插入液面以下的目的是防止倒吸
B.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇和冰醋酸
C.用CH3CH218OH和乙酸反应制取的乙酸乙酯中有18O
D.饱和碳酸钠溶液的作用是降低乙酸乙酯的溶解度及吸收少量乙酸和乙醇
难度: 简单查看答案及解析
-
关于
 (a)
(a) (b)
(b) (c)三种有机物的说法正确的是
(c)三种有机物的说法正确的是A.a、b、c的一氯代物均只有一种 B.a物质中所有碳原子处于同一平面
C.c的二氯代物有三种 D.b与c不是同分异构体
难度: 中等查看答案及解析
-
R、X、Y、Z为原子序数依次增大的四种短周期元素。Z2-的电子排布与Ne相同。它们组成的某分子结构式为
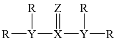 ,该化合物中除R外各原子均满足最外层8电子稳定结构。下列叙述正确的是
,该化合物中除R外各原子均满足最外层8电子稳定结构。下列叙述正确的是A.X、Y、Z的非金属性依次减弱 B.X、Y、Z的原子半径依次增大
C.R元素的单质是常见的还原剂,不能作氧化剂 D.该分子间可形成氢键
难度: 简单查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述中正确的是
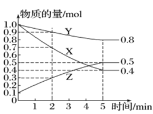
A.该反应的化学方程式可表示为:X(g) + 3Y(g) ⇌ 2Z(g)
B.平衡时X的转化率为60%
C.5min后该反应停止进行
D.前2min内,用Z表示该反应的平均速率为0.1mol·L-1·min-1
难度: 中等查看答案及解析
-
实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验,光照下反应一段时间后,下列说法正确的是
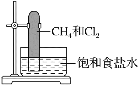
A.反应后的混合气体能使湿润的石蕊试纸变红说明生成的一氯甲烷具有酸性
B.产物之一氯仿在常温下为液态
C.甲烷和氯气在光照条件下反应,只能生成四种含氯的化合物
D.CH4和Cl2完全反应后液面上升,液体可能会充满试管
难度: 简单查看答案及解析
-
根据下图海水综合利用的工业流程图,判断下列说法正确的是
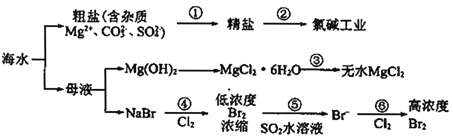
A.过程①的提纯是物理过程
B.电解饱和MgCl2溶液制取镁是由于镁是很活泼的金属
C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗2.24 L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
难度: 中等查看答案及解析
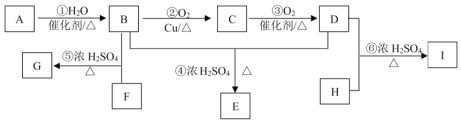
 ;H为HOCH2CH2OH。
;H为HOCH2CH2OH。