-
化学与生产、生活、科技等密切相关,下列说法不正确的是( )
A.加大清洁能源的开发利用,提高资源的利用率
B.研究使用高效催化剂,可提高反应中原料的转化率
C.氯碱工业中,采用阳离子交换膜可以提高烧碱的纯度
D.用
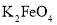 代替氯气处理饮用水,可以杀菌消毒,还能沉降水中悬浮物
代替氯气处理饮用水,可以杀菌消毒,还能沉降水中悬浮物难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.
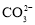 水解:
水解: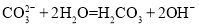
B.
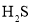 的电离:
的电离: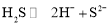
C.AgCl的沉淀溶解平衡:
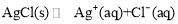
D.钢铁电化学腐蚀的负极反应式:Fe-3eˉ=Fe3+
难度: 简单查看答案及解析
-
常温下,下列溶液中各组离子一定能大量共存的是( )
A.使甲基橙变红的溶液:
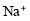 、
、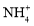 ,
,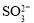 、
、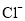
B.
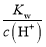 =0.1mol/L的溶液:
=0.1mol/L的溶液: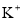 、
、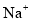 ,
,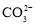 、
、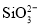
C.含有大量
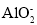 的溶液中:
的溶液中: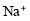 、
、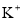 、
、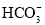 、
、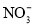
D.由水电离产生的
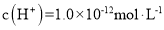 的溶液:
的溶液: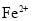 、
、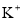 、
、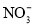 、
、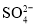
难度: 简单查看答案及解析
-
下列实验装置或者操作不能达到实验目的的是( )
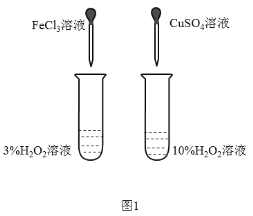
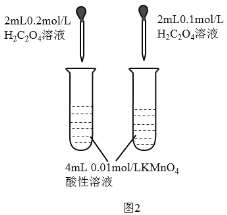
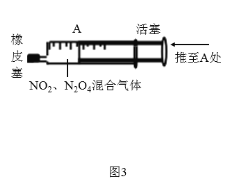
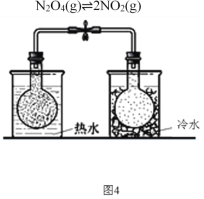
A.图1可用来探究催化剂对H2O2分解速率的影响
B.图2可用来探究浓度对化学反应速率的影响
C.图3可用来探究压强对化学平衡的影响
D.图4可用来探究温度对化学平衡的影啊
难度: 简单查看答案及解析
-
下列实验现象或操作与盐类水解无关的是( )
A.
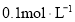 的醋酸溶液加水稀释,溶液的
的醋酸溶液加水稀释,溶液的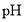 增大,导电能力减弱
增大,导电能力减弱B.用浓
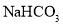 溶液与浓
溶液与浓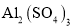 溶液混合作灭火剂
溶液混合作灭火剂C.热的纯碱溶液有利于除去废铁屑表面的油污
D.配制
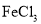 溶液时,将
溶液时,将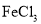 固体溶解在浓盐酸中,然后再加水稀释到所需的浓度
固体溶解在浓盐酸中,然后再加水稀释到所需的浓度难度: 简单查看答案及解析
-
一定温度下,过量锌粉与100mL 1mol/L H2SO4反应,为加快生成氢气的速率但不影响生成氢气的总量,可加入适量的( )
A.硫酸钠固体 B.硫酸铜固体 C.硫酸钾溶液 D.硝酸铜固体
难度: 简单查看答案及解析
-
下列有关物质制备的说法正确的是( )
A.制备
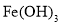 胶体:向
胶体:向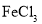 溶液中滴加氨水
溶液中滴加氨水B.制备无水
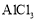 :将
:将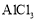 溶液加热蒸干
溶液加热蒸干C.制备
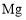 :电解
:电解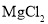 溶液
溶液D.制备少量氨气:将浓氨水滴加到碱石灰上
难度: 简单查看答案及解析
-
下列过程符合
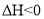 的是( )
的是( )A.
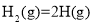 B.铝热反应 C.
B.铝热反应 C.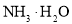 电离 D.
电离 D.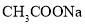 水解
水解难度: 简单查看答案及解析
-
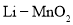 电池放电时反应为
电池放电时反应为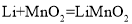 ,下列说法不正确的是( )
,下列说法不正确的是( )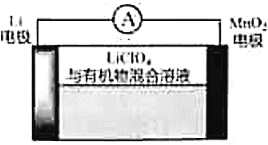
A.
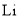 电极发生氧化反应
电极发生氧化反应B.溶液中
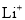 向
向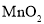 电极移动
电极移动C.可用水代替电池中的有机物
D.正极反应式为
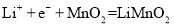
难度: 简单查看答案及解析
-
下列叙述中不正确的是( )
A.电解精炼铜,粗铜作阳极,纯铜作阴极
B.
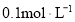 氨水加水稀释后,溶液中
氨水加水稀释后,溶液中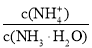 的值增大
的值增大C.反应
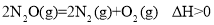 ,该反应高温下可自发进行
,该反应高温下可自发进行D.反应
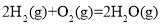 的
的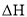 可通过下式估算,
可通过下式估算, 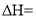 反应中形成新共价键的健能之和一反应中断裂旧共价键的键能之和
反应中形成新共价键的健能之和一反应中断裂旧共价键的键能之和难度: 简单查看答案及解析
-
下列图示与对应叙述不相符合的是( )
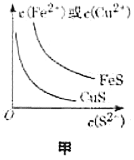
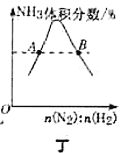
A.图甲表示一定温度下
 和
和 的沉淀溶解平衡曲线,则
的沉淀溶解平衡曲线,则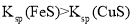
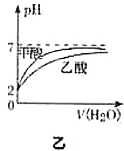
B.图乙表示
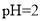 的甲酸溶液与乙酸溶液稀释时的
的甲酸溶液与乙酸溶液稀释时的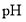 变化曲线,则酸性:甲酸>乙酸
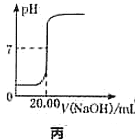
变化曲线,则酸性:甲酸>乙酸C.图丙表示用
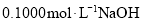 溶液滴定
溶液滴定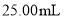 盐酸的滴定曲线,则
盐酸的滴定曲线,则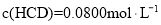
D.图丁表示反应
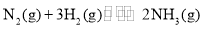 平衡时
平衡时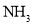 体积分数随起始
体积分数随起始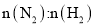 变化的曲线,则
变化的曲线,则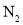 转化率:
转化率: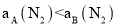
难度: 中等查看答案及解析
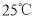 时,下列溶液中微粒的物质的量浓度关系正确的是( )
时,下列溶液中微粒的物质的量浓度关系正确的是( )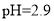 的
的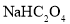 溶液中:
溶液中: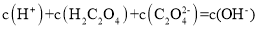
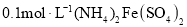 溶液中:
溶液中: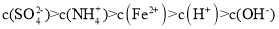
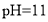 的氨水和
的氨水和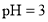 的盐酸等体积的混合液中:
的盐酸等体积的混合液中: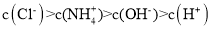
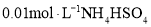 溶液中滴加氨水溶液至中性:
溶液中滴加氨水溶液至中性: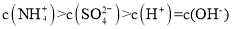
 CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。
CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。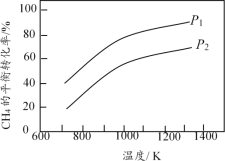
 H>0,图中压强P1>P2
H>0,图中压强P1>P2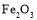 、
、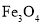 、
、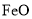 、
、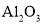 、
、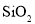 等)制备高纯氧化铁和副产品硫酸铵的流程如下:
等)制备高纯氧化铁和副产品硫酸铵的流程如下: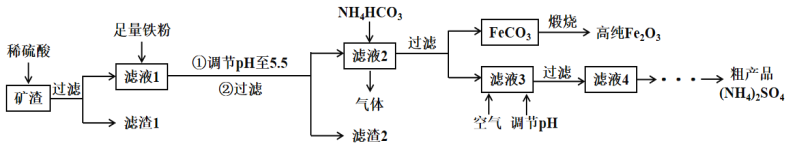
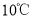 时
时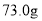 ,
,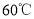 时
时
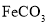 的离子方程式___________,获得的
的离子方程式___________,获得的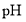 的目的是“除杂”,持续入空气的作用是____。
的目的是“除杂”,持续入空气的作用是____。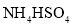 ,试用化学平衡移动原理解释其原因___________。
,试用化学平衡移动原理解释其原因___________。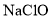 为有效成分的高效消毒剂,广范应用于家庭和公共区域的杀菌消毒。某品牌消毒液中
为有效成分的高效消毒剂,广范应用于家庭和公共区域的杀菌消毒。某品牌消毒液中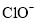 含量的测定步骤如下:
含量的测定步骤如下: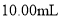 消毒液原液于锥形瓶中。
消毒液原液于锥形瓶中。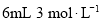 的
的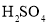 和过量的
和过量的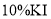 溶液,立即加盖摇匀,置于暗处约
溶液,立即加盖摇匀,置于暗处约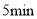 。
。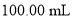 ,取出
,取出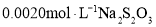 标准溶液滴定至溶液呈淡黄色,加入淀粉溶液作指示剂,继续滴加
标准溶液滴定至溶液呈淡黄色,加入淀粉溶液作指示剂,继续滴加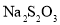 标准溶液至终点,记录标准溶液消耗的体积。(已知:
标准溶液至终点,记录标准溶液消耗的体积。(已知: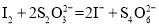 )
)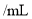
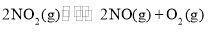
 的变化是___________。
的变化是___________。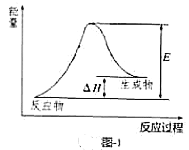
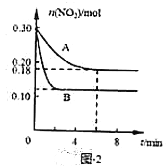
 的物质的量随时间变化的状况如图-2所示
的物质的量随时间变化的状况如图-2所示 ,反应经
,反应经 达到平衡状态,则
达到平衡状态,则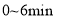 内以
内以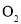 浓度变化表示的反应速率为____________。
浓度变化表示的反应速率为____________。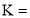 ____________。
____________。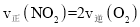 b.
b.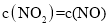
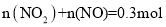 d.气体的密度保持不变
d.气体的密度保持不变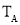 ____
____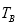 (填”>”或“<”),能使平衡正向移动且提高二氧化氮转化率的措施有____。
(填”>”或“<”),能使平衡正向移动且提高二氧化氮转化率的措施有____。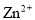 和
和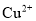 ,可采用沉淀法将其除去。
,可采用沉淀法将其除去。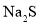 来沉淀
来沉淀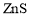 和
和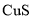 共存时,
共存时,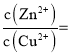 ___________。
___________。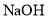 溶液来调节
溶液来调节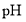 ,使
,使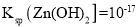
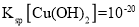
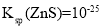
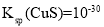
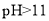 时,
时,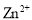 会转化为
会转化为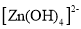
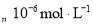
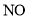 ,(主要指
,(主要指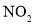 )以及
)以及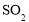 等污染气体。研究去除这些大气污染物的有效措施是环保领域的重要课题。
等污染气体。研究去除这些大气污染物的有效措施是环保领域的重要课题。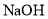 溶液吸收法。主要反应有;
溶液吸收法。主要反应有;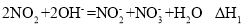
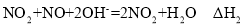
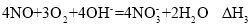
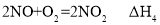
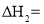 ______(用
______(用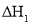 、
、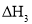 、
、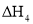 表示)。
表示)。 时,
时, 的去除率迅速下降的原因可能是________。
的去除率迅速下降的原因可能是________。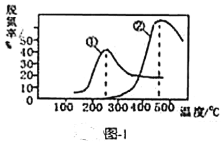
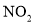 ,得到
,得到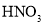 和
和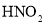 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式______。
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式______。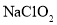 溶液作为吸收剂可同时对烟气进行脱硫,脱硝,在鼓泡反应器中通入含有
溶液作为吸收剂可同时对烟气进行脱硫,脱硝,在鼓泡反应器中通入含有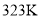 ,
,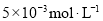 。充分反应足够长的时间后,溶液中离子浓度分析结果如下表。
。充分反应足够长的时间后,溶液中离子浓度分析结果如下表。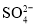
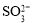
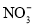
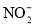
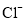
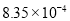
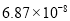
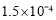
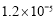
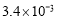
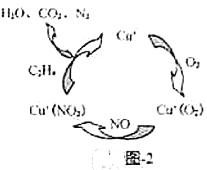
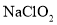 溶液脱氨过程中主要反应的离子方程式_______。
溶液脱氨过程中主要反应的离子方程式_______。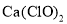 替代
替代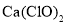 相比
相比 原理,其脱硝机理如图-2所示,若处理标况下
原理,其脱硝机理如图-2所示,若处理标况下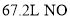 气体,需消耗标况下乙烯_______L。
气体,需消耗标况下乙烯_______L。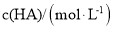
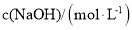
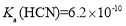 ,
,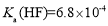 ,
,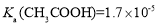 ,
,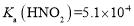 。物质的量浓度均为
。物质的量浓度均为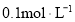 的
的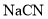 、
、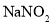 、
、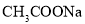 、
、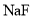 溶液,pH由大到小的顺序是___________;若将等浓度的
溶液,pH由大到小的顺序是___________;若将等浓度的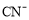 、
、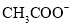 、
、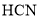 、
、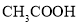 四种微粒的浓度由大到小的顺序___________。
四种微粒的浓度由大到小的顺序___________。