-
据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图。已知锌的熔点420 ℃、沸点906 ℃。则下列说法不正确的是
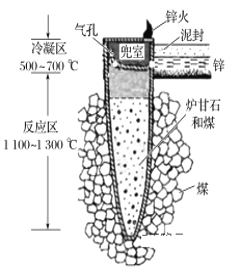
A. 升炼倭铅过程包含分解反应和氧化还原反应
B. 冶炼时锌变为蒸气在兜室冷凝为固体
C. “泥封”的目的是为了防止得到的锌被氧化
D. “锌火”是锌蒸气和一氧化碳在空气的燃烧
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值.下列叙述正确的是
A. 1.0L 1.0 mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C. 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA
D. 1mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
难度: 中等查看答案及解析
-
元素X、Y、Z均位于短周期,它们的最高及最低化合价如下表所示,下列判断一定正确的是
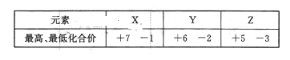
A. 原子序数:X>Y>Z.
B. Z的氢化物的沸点在同族中最高
C. X的含氧酸的酸性最强
D. Y的一种同素异形体具有漂白能力
难度: 中等查看答案及解析
-
向含有c(FeCl3)=0.2mol·L−1、c(FeCl2)=0.1mol·L−1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是
A. 该分散系的分散质为Fe2O3
B. 可用过滤的方法将黑色金属氧化物与Na+分离开
C. 向沸水中逐滴滴加0.1mol·L−1 FeCl3溶液也可得到Fe(OH)3胶体
D. 加入NaOH时发生的反应可能为Fe2++2Fe3++8OH-===Fe3O4+4H2O
难度: 中等查看答案及解析
-
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
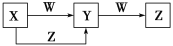
A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B. 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
难度: 困难查看答案及解析
-
铅丹(Pb3O4)可作防锈用涂料,已知铅丹中Pb元素的化合价只有+2、+4,且+2价稳定,+4价的Pb具有强氧化性,能氧化浓盐酸生成Cl2。则下列说法不正确的是
A. Pb3O4可表示为2PbO·PbO2
B. 可用PbO在空气中加热制备铅丹,其n(氧化剂)∶n(还原剂)=1:2
C. 0.1mol Pb3O4与足量的浓盐酸反应,生成Cl2 0.1mol
D. a mol Pb3O4加强热分解生成PbO,则加热过程中转移电子数为3a NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO−+ Cl−
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3−+2OH−===CaCO3↓+CO32−+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2−+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
难度: 中等查看答案及解析
-
老鼠能在含饱和多氟碳化物的溶液内部获得氧气,像鱼儿一样在水中游动,另有实验表示,把狗身上的70%的血液,换成由25%的多氟碳化物和75%的水混合成的乳液后仍可存活,科学家预测多氟碳化物可能成为血液的替代品.全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中正确的是
A. 全氟丙烷的电子式为
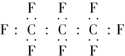 B. 原子半径C比F的小
B. 原子半径C比F的小C. 全氟丙烷分子中的化学键只有共价键 D. 全氟丙烷分子中碳链成直线型
难度: 中等查看答案及解析
-
全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O
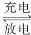 VO
VO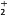 +V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4示意图如下。下列说法错误的是( )
+V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH 和H2SO4示意图如下。下列说法错误的是( )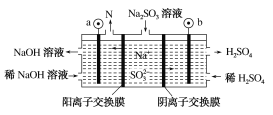
A. 全钒液流电池放电时,正极的电极反应式为VO2++2H++e-===VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 全钒液流电池充电时,V3+被氧化为VO2+
D. 电解时,b电极的反应式为SO32-+H2O-2e-=== SO42-+2H+
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
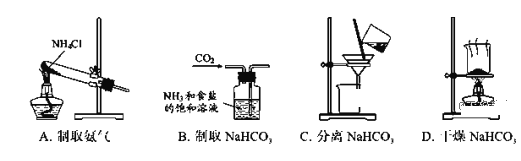
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
已知可逆反应a A(g)+b B(?)⇌c C(g)△H>0(B物质的状态未确定).关于该反应的描述正确的是( )
A.加压若平衡正向移动,则a>c
B.加入一定量的B,平衡一定正向移动
C.缩小容器的体积,各物质的浓度一定增大
D.升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定
难度: 简单查看答案及解析
-
若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
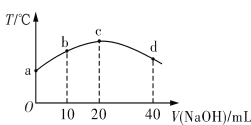
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
难度: 困难查看答案及解析
-
常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
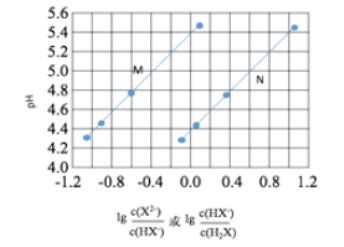
A. Ka2(H2X)的数量级为10–6
B. 曲线N表示pH与
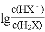 的变化关系
的变化关系C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
难度: 困难查看答案及解析
-
一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100 mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25 mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 生成的H2S气体在标准状况下的体积为2.24 L
D. 该磁黄铁矿中FexS的x=0.85
难度: 困难查看答案及解析
-
下列实验用来证明气体SO2的存在,其中正确的
①能使品红溶液褪色 ②能使湿润的蓝色石蕊试纸变红 ③能使澄清的石灰水变浑浊 ④通入到足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸 ⑤通入到溴水中使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀生成
A. ①②④⑤ B. 都不能证明
C. ①⑤能证明 D. 只有⑤能证明
难度: 中等查看答案及解析
 O2(g)=CO(g)ΔH =–110.4kJ•mol-1,
O2(g)=CO(g)ΔH =–110.4kJ•mol-1,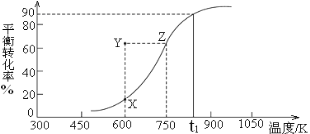
 HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
 NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5