-
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是 ( )。
A. 电子排布式为1s22s22p63s23p63d34s2
B. 该元素为V
C. 该元素为ⅡA族元素
D. 该元素位于d区
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①ls22s22p63s23p4②ls22s22p63s23p3 ③ls22s22p3 ④ls22s22p5, 则下列有关比较中正确的是
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
将5 mol·L-1的盐酸10 mL稀释到200mL,再取出5 mL,这5 mL溶液的物质的量浓度是( )
A. 0.05 mol·L-1 B. 0.25 mol·L-1 C. 0.1 mol·L-1 D. 0.5 mol·L-1
难度: 简单查看答案及解析
-
准确量取25.00毫升高锰酸钾溶液,可选用的仪器是
A. 50 mL量筒 B. 10 mL量筒 C. 50 mL酸式滴定管 D. 50 mL碱式滴定管
难度: 中等查看答案及解析
-
下列各组物质中,酸性由强到弱排列顺序错误的是( )
A. HClO4 H2SO4 H3PO4 B. HClO4 HClO3 HClO2
C. HClO HBrO4 HIO4 D. H2SO4 H2SO3 H2CO3
难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ/mol)。
I1
I2
I3
I4
……
R
740
1500
7700
10500
……
下列关于元素R的判断中一定正确的是
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
难度: 中等查看答案及解析
-
电负性差值为零时,可形成( )
A. 配位键 B. 非极性共价键
C. 金属键 D. 离子键
难度: 中等查看答案及解析
-
下列关于同一种原子中的基态和激发态说法中,正确的是( )
A. 基态时的能量比激发态时高
B. 激发态时比较稳定
C. 由基态转化为激发态过程中吸收能量
D. 电子仅在激发态跃迁到基态时才会产生原子光谱
难度: 中等查看答案及解析
-
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是
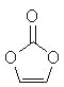
A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6g该物质完全燃烧得到6.72LCO2
难度: 中等查看答案及解析
-
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A. 半导体材料砷化镓 B. 吸氢材料镧镍合金
C. 透明陶瓷材料硒化锌 D. 超导材料K3C60
难度: 简单查看答案及解析
-
配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物[Cu(NH3)4](OH)2的中心离子、 配体和配位数分别为( )
A. Cu2+ 、NH3、4 B. Cu+、NH3、4
C. Cu2+ 、OH-、2 D. Cu2+ 、NH3、2
难度: 中等查看答案及解析
-
膦(PH3)又称磷化氢,在常温下是一种无色、有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的立体构型是三角锥形。则下列关于PH3的叙述正确的是( )
A. PH3分子中有未成键的孤电子对
B. PH3是空间对称结构
C. PH3是一种强氧化剂
D. PH3分子中的P—H键间夹角是90°
难度: 中等查看答案及解析
-
下表所示为部分短周期元素的原子半径及主要化合价,据下表判断叙述正确的是( )
元素代号
A
B
C
D
E
F
G
原子半径/nm
0.152
0.160
0.089
0.143
0.102
0.099
0.071
主要化合价
+1
+2
+2
+3
+6,-2
-1
-1
A. 单质的活泼性顺序为:A>C>B>D
B. 气态氢化物的热稳定性HG>HF(F元素代号的氢化物)>H2E
C. B2+,D3+,E2-,G-四种离子的核外电子排布相同
D. 单质A在O2中加热生成A2O2
难度: 中等查看答案及解析
-
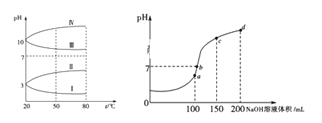
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/(mol·L-1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
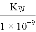 mol/L
mol/LC.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
难度: 简单查看答案及解析
-
已知25 ℃,醋酸溶液中各微粒存在下述关系:K=
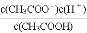 =1.75×10-5,下列有关说法可能成立的是
=1.75×10-5,下列有关说法可能成立的是A. 25 ℃条件下,向该溶液中加入一定量的盐酸时,K=8×10-5
B. 25 ℃条件下,向该溶液中加入一定量的盐酸时,K=2×10-4
C. 标准状况下,醋酸溶液中K=1.75×10-5
D. 升高到一定温度,K=7.2×10-5
难度: 简单查看答案及解析
-
一定条件下,下列反应不可能自发进行的是( )
A. 2O3(g)
 3O2(g) ΔH<0
3O2(g) ΔH<0B. 2CO(g)
 2C(s)+O2(g) ΔH>0
2C(s)+O2(g) ΔH>0C. N2(g)+3H2(g)
 2NH3(g) ΔH<0
2NH3(g) ΔH<0D. CaCO3(s)
 CaO(s)+CO2(g) ΔH>0
CaO(s)+CO2(g) ΔH>0难度: 简单查看答案及解析
-
如右图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,正确的是( )
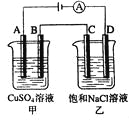
A. 甲烧杯中A极上最多可析出铜0.64g
B. 甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C. 乙烧杯中滴入酚酞试液,D极附近先变红
D. 烧杯中C极上电极反应式为4H++4e-=2H2↑
难度: 中等查看答案及解析
-
结合下图判断下列叙述正确的是( )
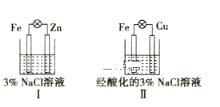
Ⅰ和Ⅱ中正极均被保护
Ⅰ和Ⅱ中Cl-均向Fe电极移动
C.Ⅰ和Ⅱ中负极反应均是Fe-2e-
 Fe2+
Fe2+D.Ⅰ和Ⅱ中正极反应均是O2+4e-+2H2O
 4OH-
4OH-难度: 中等查看答案及解析
-
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A. 18O 31P
B. 19F 12C
C. 元素周期表中ⅢA族所有元素的原子
D. 元素周期表中第3周期元素的所有原子
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
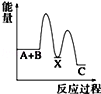 B.
B. 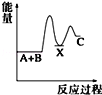
C.
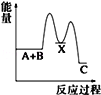 D.
D. 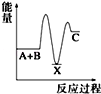
难度: 中等查看答案及解析
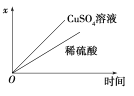
 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。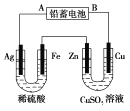
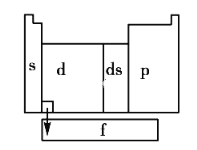
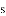 区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。
区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。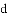 区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。
区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。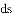 区中,族序数最大、原子序数最大的元素,原子的价电子排布式为__________。
区中,族序数最大、原子序数最大的元素,原子的价电子排布式为__________。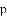 区中,第2周期VA族元素原子价电子排布图为__________。
区中,第2周期VA族元素原子价电子排布图为__________。