-
通过实验、观察、类比、推理等方法得出正确的结论是化学研究的方法之一。下列反应的推断或解释正确的是( )
选项
操作
实验现象
推断或解释
A
燃烧的钠粒放入CO2中
燃烧且有白色和黑色颗粒产生
黑色颗粒是炭,白色颗粒可能是Na2CO3
B
NH3通入到AgNO3溶液中
先有沉淀后消失
AgOH 具有两性
C
乙醇蒸气通过灼热的Fe2O3 固体
红色固体变黑色,且有刺激性气味
乙醇还原Fe2O3一定生成Fe 和乙醛
D
灼热的木炭放入浓硝酸中
放出红棕色气体
一定是木炭与浓硝酸反应生 成 NO2 呈红棕色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z、Q的原子序数依次增大,X与W、Y可分别形成常见的化合物W2X、W2X2、Y2X、Y2X2,化合物Z2Q3溶于水有大量白色胶状沉淀和臭鸡蛋气味的气体生成。下列有关叙述正确的是( )
A. 简单离子半径的大小:Q>Y>Z>X>W
B. W与N(氮)元素可形成NW5化合物
C. 相同条件下,YWQ、YXW、Y2Q溶液的pH依次增大
D. Y、Z、Q的最高价氧化物对应的水化物之间不能两两反应
难度: 中等查看答案及解析
-
化学与生活、社会密切相关。下列说法正确的是
A. 压电陶瓷不属于新型无机非金属材料
B. “雾霾天气”、“光化学烟雾”的形成都与氮氧化物无关
C. 焊接钢材时,分别用饱和Na2CO3和NH4Cl溶液处理焊接点
D. 亚硝酸钠可作发色剂,可在肉制品中多加一些以保持良好的色泽
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞显红色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水电离出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的有
①2 mol SO2和1 mol O2在V2O5存在的条件下于密闭容器中加热充分反应后,容器内物质的分子数等于2NA
②在精炼铜或电镀铜的过程中,当阴极析出32 g铜时转移电子数均为NA
③含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
④12.4 g白磷晶体中含有的P—P键数目是0.6NA
⑤6.4 g的S2和S3混合物中,含硫原子总数为0.2NA
⑥N2(g)+ 3H2(g)=2NH3(g)△H=-92.4 kJ/mol,当转移的电子数为6NA时,该反应吸收 92.4 kJ的热量
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是
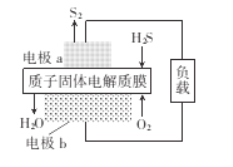
A. a是负极,电池工作时,电子的流动方向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+ = 2H2O
D. 当电路中通过4 mol电子时,有4 molH+经质子膜进入正极区
难度: 中等查看答案及解析
-
下列是从海藻灰和智利硝石矿层中提取碘的主要反应,下列说法正确的是
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
A. 氧化性:MnO2>SO42->IO>I2
B. I2在反应①中是还原产物,在反应②中是氧化产物
C. 反应①②中生成等量的I2时转移电子数之比为1∶5
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO)>c(H2SO3)>c(SO32-)
难度: 中等查看答案及解析
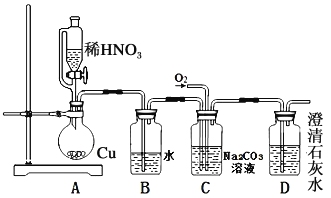
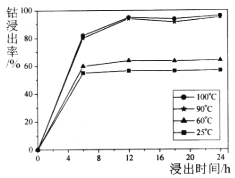
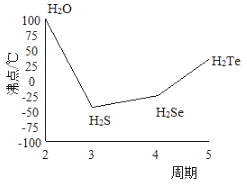
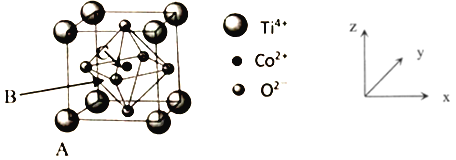
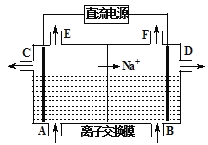
 O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。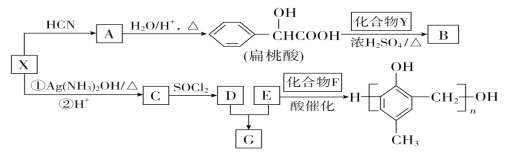
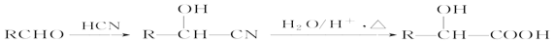
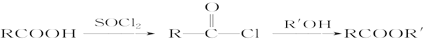 (R、R’代表烃基)
(R、R’代表烃基)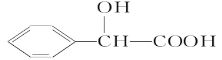 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。