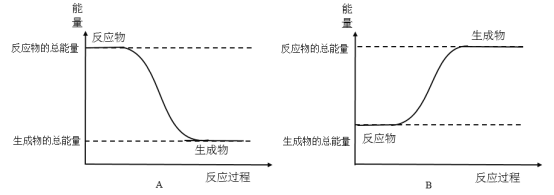
-
下列有关化学用品的安全使用(或措施)正确的是( )
A.在实验室发现钠着火时,立即用水浇灭
B.装运乙醇的包装箱上应贴上易燃液体的危险品标志图标
C.为了预防新冠肺炎,在家中关闭门窗用大量的95%的酒精进行环境消毒
D.食品添加剂为各种各样的化学性质,所以国家应立法杜绝使用食品添加剂
难度: 简单查看答案及解析
-
下列生活应用实例中,涉及氧化还原反应的是
A.氢氧化铝治疗胃酸过多 B.独宿江城蜡炬残(杜甫《宿府》)
C.小苏打用于食品发酵剂 D.要留清白在人间(于谦《石灰吟》)
难度: 简单查看答案及解析
-
《本草经集注》中关于鉴别硝石和朴硝的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应的原理。则硝石的主要成分可能是
A.KNO3 B.Fe3O4 C.Na2SO4 D.NaNO3
难度: 简单查看答案及解析
-
今年口罩成为抗击新冠肺炎的必备品,口罩的主体过滤材料为聚丙烯熔喷布、聚丙烯是由丙烯经过加聚反应制得。下列有关丙烯的说法错误的是( )
A.丙烯和乙烯互为同系物 B.丙烯能使酸性高锰酸钾溶液褪色
C.丙烯可以使溴水褪色 D.丙烯分子中碳原子在一条直线上
难度: 中等查看答案及解析
-
渔业养殖业要求水体中溶解的O2的量不能低于3 mg/L。已知某水体中溶解的O2的浓度为4.8 mg/L,则1 m3水中溶解的O2的物质的量为( )
A.0.15 mol B.0.30 mol C.1.5 mol D.3.0 mol
难度: 简单查看答案及解析
-
乙醚是一种吸入性麻醉剂,熔点为
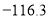 ℃,沸点为
℃,沸点为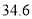 ℃,微溶于水,易溶于乙醇。要从乙醇与乙醚的混合物中分离出乙醚,需要用到的仪器是
℃,微溶于水,易溶于乙醇。要从乙醇与乙醚的混合物中分离出乙醚,需要用到的仪器是A.
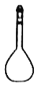 B.
B.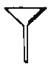 C.
C. D.
D.
难度: 简单查看答案及解析
-
食盐中的碘以碘酸钾
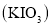 形式存在,可根据反应
形式存在,可根据反应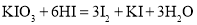 ,验证食盐中存在
,验证食盐中存在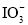 。根据上述反应,下列说法正确的是
。根据上述反应,下列说法正确的是A.由
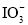 知,
知,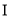 是第ⅤA族元素
是第ⅤA族元素B.
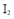 是氧化产物,
是氧化产物,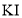 是还原产物
是还原产物C.对应的离子方程式为
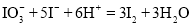
D.每生成
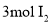 ,转移电子的物质的量为
,转移电子的物质的量为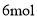
难度: 中等查看答案及解析
-
下列“实验结论”与“实验操作与现象”相符的一组是
选项
实验操作与现象
实验结论
A
向某溶液中加入AgNO3溶液,有白色沉淀生成
该溶液中一定含有Cl-
B
向某溶液中加入BaCl2溶液,有白色沉淀生成,再滴加过量稀盐酸,沉淀不溶解
该溶液中一定含有
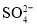
C
将SO2通入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色
SO2具有漂白性
D
将NH3通过灼热的氧化铜固体,固体由黑色变为红色
NH3具有还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
糖类、油脂、蛋白质、煤、石油与人类生活密切相关。下列有关说法正确的是
A.油脂属于酯类,可以发生水解反应
B.纯棉与真丝衣服的主要成分均是蛋白质
C.检验淀粉是否水解完全可以使用新制Cu(OH)2悬浊液
D.煤的干馏与石油的分馏均是物理变化
难度: 简单查看答案及解析
-
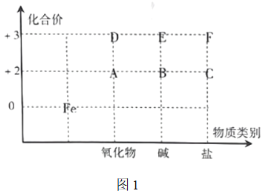
离子方程式能够反映出溶液中反应的实质,下列指定反应的离子方程式正确的是。
A.用醋酸溶解水垢(CaCO3):CaCO3+2H+=Ca2++CO2↑+H2O
B.Na2O2粉末加入水中:Na2O2+H2O=2Na++2OH-+H2↑
C.金属钠投入到水中:Na+H2O=Na++OH-+H2↑
D.向过量NH4HSO4溶液中滴加几滴NaOH稀溶液:H++OH-= H2O
难度: 中等查看答案及解析
-
在实验室有瓶未知溶液,小明测得该溶液中含有K+、Fe3+、
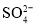 和Q共4种离子,且c(K+):c(Fe3+):c(
和Q共4种离子,且c(K+):c(Fe3+):c(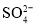 ):c(Q)=4:1:3:1,则Q可能是
):c(Q)=4:1:3:1,则Q可能是A.OH- B.Cl- C.
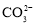 D.Na+
D.Na+难度: 简单查看答案及解析
-
某同学为了完成相应的实验目的,所采用的实验装置不合理的是()。
选项
A
B
C
D
实验目的
分离乙醇与水
抽取并观察Fe(OH)2沉淀
比较Zn与Cu的活泼性
抽取少量的铁
实验装置
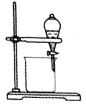
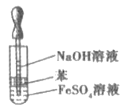
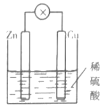
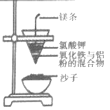
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关氨气的制取、收集并验证其部分性质的装置和原理不能达到实验目的的是
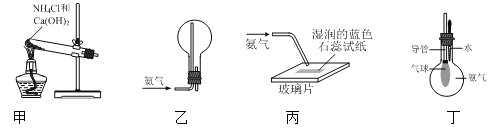
A.用甲装置制取少量氨气
B.用乙装置收集氨气
C.用丙装置验证氨气溶于水呈碱性
D.用丁装置验证氨气极易溶于水
难度: 简单查看答案及解析
-
下列化学用语表达正确的是( )
A.CH4的比例模型:
 B.O2-的结构示意图:
B.O2-的结构示意图: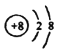
C.N2的结构式:N=N D.CO2的电子式
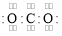
难度: 中等查看答案及解析
-
某合金耐腐蚀、强度大,它与铁的一些物理性质的比较如下表所示:
熔点/℃
密度
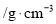
硬度(金刚石为10)
导电性(银为100)
某合金
2500
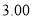
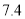
78
铁
1535
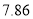
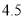
17
从以上信息可知,该合金不适合作
A.保险丝 B.门窗框 C.耐火材料 D.导弹外壳
难度: 简单查看答案及解析
-
元素周期表与同位素的应用比较广泛,下列叙述中不正确的是( )
A.通过测定文物中
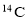 的含量,可以推断出文物的年代
的含量,可以推断出文物的年代B.利用放射性同位素释放的射线可以杀死人体内的恶性肿瘤
C.研制农药通常考虑含有元素周期表右上角元素(氟、氯、硫、磷等)的有机物
D.在元素周期表中金属与非金属交界处的元素的单质或化合物中寻找优良的催化剂
难度: 中等查看答案及解析
-
材料科学是以化学为基础的一门新兴热门学科,下列有关高中化学学习过的材料的描述错误的是
A.纳米材料属于胶体 B.钢、铝合金属于金属材料
C.陶瓷、玻璃属于无机非金属材料 D.聚乙烯、蛋白质属于有机高分子材料
难度: 简单查看答案及解析
-
铊(Tl)被广泛用于电子、军工、航天、化工、冶金、通讯等各个方面。已知铊(Tl)元素位于元素周期表中第6周期第ⅢA族,下列叙述中不正确的是( )
A.铊单质能与盐酸反应放出H2 B.铊的原子半径小于同周期的Pb(ⅣA族)
C.铊原子核外电子排布有6个电子层 D.铊原子最外层有3个电子
难度: 中等查看答案及解析
-
有机物种类繁多,与人类生活、生产有密切关系,下列有关常见有机物的说法错误的是( )
A.C5H12属于烷烃,可能的结构有3种
B.C4H9Cl不属于烃,可能的结构有4种
C.可以用H2在一定条件下除去乙烷中的乙烯
D.乙醇、乙酸和乙酸乙酯可以用饱和NaHCO3溶液鉴别
难度: 中等查看答案及解析
-
思维导图是学习物质性质的常用方法,如图是某同学学习苯时画的思维导图,下列有关说法正确的是
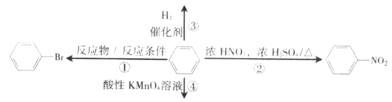
A.①的反应物为浓溴水,反应条件为FeBr3作催化剂且加热
B.②发生的反应为取代反应,浓H2SO4作催化剂与吸水剂
C.③发生的反应为加成反应,说明苯分子中含有碳碳双键
D.④发生的反应为氧化反应,现象是酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
以铜精矿(主要含有
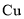 、
、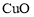 ,还有少量
,还有少量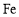 、
、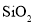 )为原料制备胆矾
)为原料制备胆矾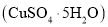 的工艺流程如下图所示。下列说法错误的
的工艺流程如下图所示。下列说法错误的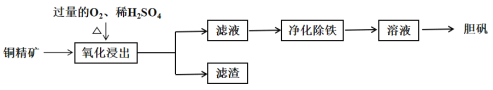
A.通常将铜精矿研磨成粉末,以提高反应速率
B.“氧化浸出”过程会产生污染气体
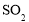
C.“滤渣”的成份为
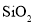
D.“胆矾”为纯净物,属于盐类
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
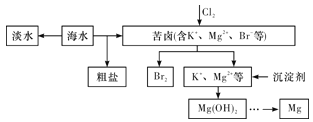
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.将氯气通入苦卤中发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2
C.在工业上一般采用电解MgCl2溶液的方法得到金属镁单质
D.海水晒盐是利用了蒸发结晶的原理,属于物理变化
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数,下列叙述正确的是
A.常温常压下,0.2gD2
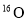 所含的中子数为0.1NA
所含的中子数为0.1NAB.标准状况下,11.2L Cl2溶于水,转移的电子数为0.5NA
C.0.1mol⋅L−1的Na2SO4溶液中含有的Na+数为0.2NA
D.标准状况下,11.2LCH3CH2OH含有的分子数为0.5NA
难度: 中等查看答案及解析
-
下列实验能达到预期目的是
序号
实验操作
实验目的
A
MgCl2、AlCl3溶液中分别加入过量氨水
比较镁、铝的金属性强弱
B
测定H2O、H2S的热分解温度
比较氧、硫的非金属性强弱
C
室温下,分别将铝片与铁片浸入浓硝酸中
比较铝、铁的金属性强弱
D
将稀盐酸滴加到NaHCO3溶液中
比较氯、碳的非金属性强弱
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
V mL密度为ρ g·mL-1的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为w%,物质的量浓度为c mol·L-1,那么下列关系式正确的是( )
A.
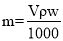 B.
B.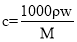 C.
C.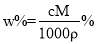 D.
D.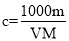
难度: 中等查看答案及解析
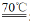 5X-+
5X-+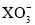 +3H2O”。
+3H2O”。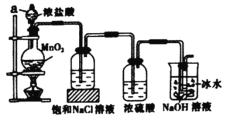
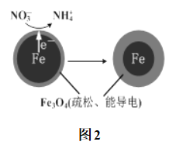
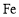 可以去除水体中的
可以去除水体中的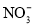 (原理如图2)。若有1mol
(原理如图2)。若有1mol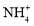 ,则参加反应的
,则参加反应的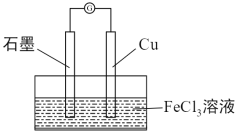
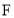 是一种具有香味的油状液体。相关物质的转化关系如图所示。
是一种具有香味的油状液体。相关物质的转化关系如图所示。
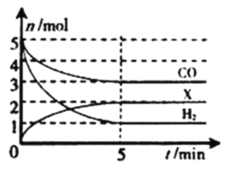
 CO(g)+H2(g)。
CO(g)+H2(g)。