-
下列诗句中所涉及的化学现象描述错误的是
A.“春蚕到死丝方尽”中的“丝”的主要成分是蛋白质
B.“落日川渚寒,愁云绕天起”中的“云”属于胶体
C.“爆竹声中一岁除”涉及了氧化还原反应
D.“日照香炉生紫烟”描述了碘的升华
难度: 中等查看答案及解析
-
下列说法或做法正确的是
A.可用甲醛溶液给食物保鲜
B.可用CCl4作燃料
C.可用K2Cr2O7检验司机是否酒后驾车
D.可用水鉴别汽油和乙酸乙酯
难度: 中等查看答案及解析
-
下列离子方程式书写错误的是
A.八水合氢氧化钡与氯化铵反应:Ba(OH)2·8H2O+2NH4Cl=Ba2++2NH3↑+10H2O
B.H2C2O4使酸性KMnO4溶液褪色:2
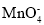 +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2OC.Mg(HCO3)2溶液与足量NaOH溶液反应:Mg2++4OH-+2
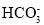 =Mg(OH)2↓+2H2O+2
=Mg(OH)2↓+2H2O+2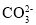
D.用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=Cu2++2Fe2+
难度: 中等查看答案及解析
-
已知恒温恒容条件下进行反应:2SO2(g)+O2(g)
 2SO3(g)△H<0。下列说法正确的是
2SO3(g)△H<0。下列说法正确的是A.加入高效催化剂,既可增大反应速率,也可增大反应物的平衡转化率
B.若将容器改为恒压,通入惰性气体,平衡不移动
C.达到平衡后,保持O2的浓度不变,扩大容器体积,平衡正向移动
D.若将容器改为绝热恒容,则到达平衡的时间缩短
难度: 中等查看答案及解析
-
Mg/Co3O4电池是一种新型二次电池(如图),该电池采用MgSO4和CoSO4的混合溶液作为电解质溶液。下列说法错误的是
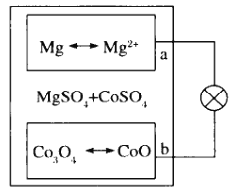
A.放电时,溶液中
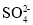 移向a极
移向a极B.放电时,b极的电极反应式为Co3O4+2e-+Co2+=4CoO
C.充电时,b极与外接电源的负极相连
D.充电时,外电路通过2mol电子,理论上电解质溶液质量增重35g
难度: 中等查看答案及解析
-
下列说法正确的是
A.NH3和H2O可以形成喷泉实验,则Cl2和H2O也可以形成喷泉实验
B.Na2O2和CO2可以生成Na2CO3和O2,则Na2O2和SO2也可以生成Na2SO3和O2
C.Zn可以置换出CuSO4溶液中的Cu,则Na也可以置换出CuSO4溶液中的Cu
D.常温下,浓硫酸可以使Al钝化,则常温下浓硝酸也可以使Al钝化
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期元素,X的核外电子数是其周期数的3倍,Y的一种单质可以吸收紫外线,Z的离子半径是同周期主族元素中最小的,W的最高价含氧酸在短周期元素的最高价含氧酸中酸性最强。下列说法错误的是
A.原子半径:Z>Y
B.简单氢化物的稳定性:Y<X
C.ZW3属于强电解质
D.Y、W两者形成的化合物可能具有强氧化性
难度: 中等查看答案及解析
-
已知常温下,H2CrO4的Ka2=3.2×10-7,BaCO3的Ksp=2.5×10-9,BaCrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.向m点的悬浊液中通入HCl,能使m点沿mp线向p点方向移动
B.通过蒸发可使q点溶液向p点移动
C.常温下,BaCrO4(s)+
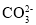 (aq)
(aq) BaCO3(s)+
BaCO3(s)+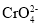 (aq)的K=6.4×10-2
(aq)的K=6.4×10-2D.n点时,沉淀溶解的速率大于离子结晶的速率
难度: 困难查看答案及解析
-
已知反应3A(g)
 B(g)+C(g)反应过程中的能量变化如下图所示,若在恒温恒容条件下通入一定量的A(g)进行上述反应。下列说法错误的是
B(g)+C(g)反应过程中的能量变化如下图所示,若在恒温恒容条件下通入一定量的A(g)进行上述反应。下列说法错误的是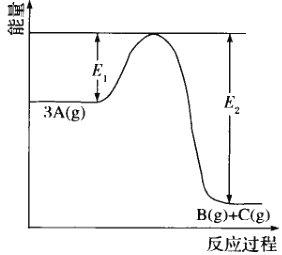
A.使用催化剂,能同时降低E1和E2
B.升高温度,v逆增大,v正减小
C.达到平衡后再通入A(g),能增大A(g)的平衡转化率
D.若加压到一定程度平衡向左移动,可能是高压下A(g)转化成了液体
难度: 简单查看答案及解析
-
已知常温下H2A的Ka1=2.7×10-6,Ka2=6.3×10-10,HClO的Ka=3×10-8。下列说法正确的是
A.NaHA溶液中存在:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.向Na2A溶液中通入少量Cl2的离子方程式:Cl2+2A2-+H2O=Cl-+ClO-+2HA-
C.NaClO溶液中水电离出的c(H+)·c(OH-)大于等浓度的Na2A溶液中水电离出的c(H+)·c(OH-)
D.等浓度、等体积的NaHA和NaClO的混合溶液中存在:c(OH-)=c(H+)+c(ClO-)+c(HA-)+c(HClO)+c(H2A)
难度: 困难查看答案及解析
-
联氨(又称肼,N2H4是无色液体)为二元弱碱,在水中的电离方式与氨相似。常温下,向10mL0.1mol/L的联氨溶液中,滴加0.1mol/L的HCl溶液xmL溶液中N2H4、
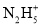 、
、 的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示,下列说法错误的是
的物质的量分数δ随溶液pOH[pOH=-lgc(OH-)]变化的曲线如图所示,下列说法错误的是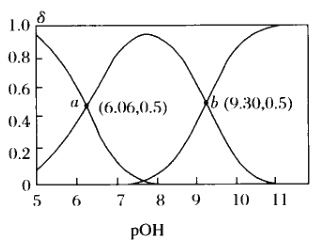
A.联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2
B.pOH=6.06时,加入HCl溶液的体积为5mL
C.加入HCl溶液体积为10mL时溶液中:2c(
 )+c(
)+c(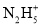 )<c(Cl-)
)<c(Cl-)D.反应N2H4+H+

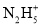 的K=107.94
的K=107.94难度: 困难查看答案及解析
-
下列有关电化学的说法正确的是
A.使用铅蓄电池在铝上镀锌时,当铅蓄电池内部SO42-减少2mol时,铝电极上增重65g
B.食品包装袋中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其中铁、碳质量比越大,脱氧效果越好
C.可用电解熔融AlCl3的方法冶炼Al
D.铜银合金置于稀硫酸中,铜会发生析氢腐蚀
难度: 中等查看答案及解析
-
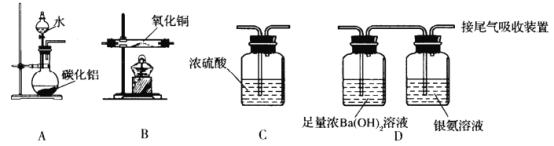
已知氨气可以和氧化铜反应,根据此反应并提供如下的实验装置及试剂,可测定Cu的相对原子质量Ar(Cu)(近似值)。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O)(根据需要部分装置可重复选用,且A装置中生成的氨气过量)。下列说法错误的是
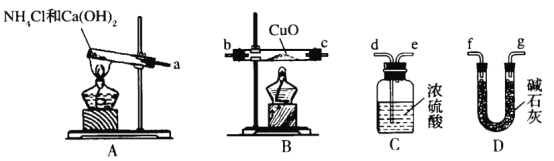
A.装置的连接顺序为a→f→g→b→c→f→g→d→e
B.若实验测得m(CuO)=a g,m(H2O)=b g,由此可计算Ar(Cu)=

C.若CuO未反应完全,则测定结果偏低
D.C装置的作用为吸收尾气和防止空气中的水蒸气、CO2进入D装置
难度: 中等查看答案及解析
-
下列说法错误的是
A.有化学键断裂或形成的变化一定是化学变化
B.镀锌铁器的镀层破损后仍能保护铁不被腐蚀
C.反应M(s)=N(g)+Q(g)△H=+180kJ/mol,在高温下能自发进行
D.在做中和热测定的实验时,若使用金属搅拌棒会导致计算出的反应热(△H)偏大
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法错误的是
A.13g苯和苯乙烯(
 )含C-H键的数目为NA
)含C-H键的数目为NAB.标准状况下,2.24LHF中含有的质子数为NA
C.常温下,1LpH=4的AlCl3溶液中,由水电离出的OH-的数目为10-4NA
D.加热时,1molCl2与56gFe充分反应时,转移的电子数为2NA
难度: 中等查看答案及解析
-
Na2FeO4可用于制备新型非氯高效消毒剂高铁酸钾(K2FeO4)。实验室制备Na2FeO4的原理如图所示。下列说法正确的是
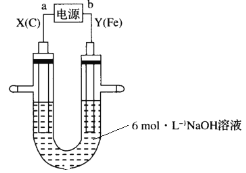
A.a为电源正极
B.Y电极的电极反应式为Fe+8OH--6e-=
 +4H2O
+4H2OC.每生成0.05mol
 ,有0.4molOH-从X电极流向Y电极
,有0.4molOH-从X电极流向Y电极D.X电极上每生成标准状况下6.72LH2,电解质溶液中OH-的浓度降低0.02mol/L
难度: 中等查看答案及解析
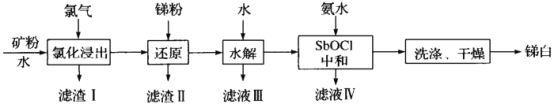
 2SO3(g)△H=______kJ/mol。
2SO3(g)△H=______kJ/mol。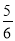 。从开始到平衡,v(SO3)=______________,O2的平衡转化率为_______。
。从开始到平衡,v(SO3)=______________,O2的平衡转化率为_______。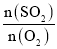 的变化如图所示,则a=_______,用平衡压强(该物质的体积分数×总压强)代替平衡浓度,则500℃时,该反应的Kp=________。
的变化如图所示,则a=_______,用平衡压强(该物质的体积分数×总压强)代替平衡浓度,则500℃时,该反应的Kp=________。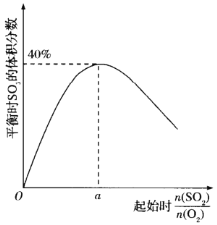
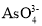 中和
中和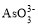 中O-As-O键角较大的是______________,原因是_________。
中O-As-O键角较大的是______________,原因是_________。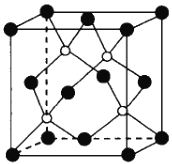
 )是重要的有机合成中间体,以A为原料合成F的一种合成路线如下:
)是重要的有机合成中间体,以A为原料合成F的一种合成路线如下: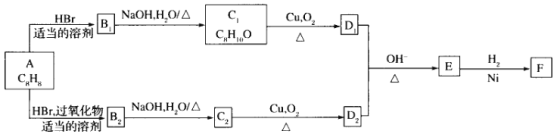
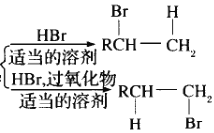 (请注意H和Br所加成的位置)
(请注意H和Br所加成的位置)