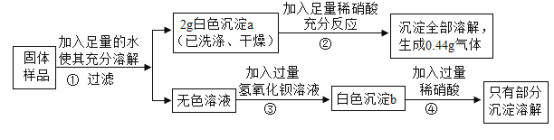
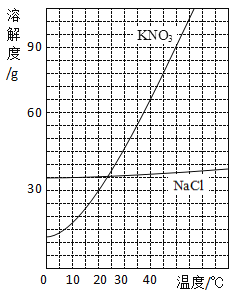
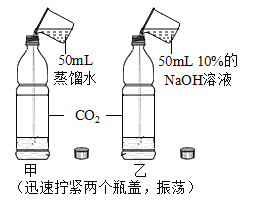
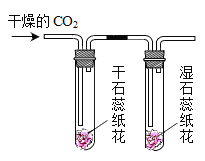
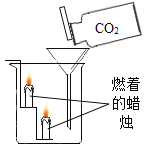
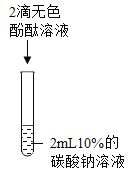
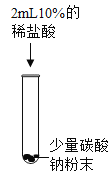
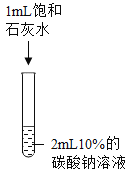
-
下列物质属于纯净物的是
A.不锈钢 B.碘酒
C.氢气 D.粗盐
难度: 简单查看答案及解析
-
适当增加蛋白质的摄入量,有助于提高人体免疫力。下列食物富含蛋白质的是
A.菠菜 B.鸡蛋
C.香蕉 D.馒头
难度: 简单查看答案及解析
-
下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
难度: 简单查看答案及解析
-
蚊虫叮咬时释放出的液体中含有蚁酸(显酸性),为了减轻痒痛,可以在被叮咬处涂抹
物质名称
西红柿汁
柠檬汁
牛奶
小苏打水
pH范围
4~5
2~3
6~7
8~9
A.西红柿汁
B.柠檬汁
C.牛奶
D.小苏打水
难度: 简单查看答案及解析
-
氧化铟(In2O3)是制造触摸屏的主要材料。氧化铟中铟(In)元素的化合价是
A.+1 B.+2 C.+3 D.+6
难度: 简单查看答案及解析
-
化学元素与人体健康息息相关。下列关于元素影响人体健康的表述不正确的是
A.缺氟易产生龋齿
B.缺硒会引起甲状腺肿大
C.老年人缺钙会导致骨质疏松
D.长期缺铁会引发缺铁性贫血
难度: 简单查看答案及解析
-
下列对一氧化碳性质的描述,属于化学性质的是
A.常温下为无色、无味的气体
B.极难溶于水
C.相同状况下,密度比空气略小
D.具有可燃性
难度: 简单查看答案及解析
-
下列物质由分子直接构成的是
A.氧气 B.金刚石 C.铜 D.氯化钠固体
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A.氧化钙 Ca2O B.钠离子 Na+1
C.两个硫原子S2 D.两个甲烷分子 2CH4
难度: 简单查看答案及解析
-
下列对宏观事实的微观解释不正确的是
A.水通电生成氢气和氧气——化学反应中分子发生了改变
B.压瘪的乒乓球在热水中能鼓起来——温度升高,分子变大
C.端午时节粽飘香——分子不断运动
D.一氧化碳和二氧化碳的化学性质不同——不同种分子的性质不同
难度: 简单查看答案及解析
-
空气是一种重要的资源。下列有关空气的说法正确的是
A.食品包装袋中充入氧气可延长食品的保质期
B.空气污染指数越高,空气质量越好
C.氧循环对维持自然界中物质、能量及生态的平衡有重要意义
D.分离液态空气得到氧气和氮气的过程中发生了化学变化
难度: 简单查看答案及解析
-
下列对实验现象的描述不正确的是
A.向铁锈中加入稀硫酸,振荡,铁锈逐渐溶解,溶液变为浅绿色
B.向氯化铜溶液中滴加氢氧化钠溶液,生成蓝色沉淀
C.灼烧纯羊毛线,产生烧焦羽毛的特殊气味
D.红热的细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
难度: 简单查看答案及解析
-
化肥和农药影响农作物的产量。下列说法正确的是
A.使用化肥越多,农作物产量越高
B.铵态氮肥与熟石灰混合使用可以提高肥效
C.大量使用农药会导致土壤和食品污染,因此要杜绝使用农药
D.适当增大蔬菜大棚内二氧化碳的浓度,可以促进蔬菜的光合作用
难度: 简单查看答案及解析
-
2019 年诺贝尔化学奖颁给了约翰·古迪纳夫、斯坦利·威廷汉和吉野彰三位科学家,以表彰他们在锂离子电池领域的卓越贡献。下图是锂元素在周期表中的部分信息及原子结构示意图。下列说法正确的是
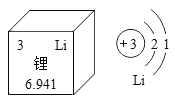
A.锂原子的核电荷数为 1
B.锂原子在化学反应中容易失去一个电子
C.锂元素的相对原子质量为 6.941 g
D.氯化锂的化学式为LiCl2
难度: 简单查看答案及解析
-
常用的医用酒精是体积分数为 75%的乙醇溶液,可用于杀菌消毒。乙醇分子的模型如图所示,其中
 代表碳原子,
代表碳原子, 代表氢原子,
代表氢原子,  代表氧原子。下列有关乙醇的说法不正确 的是
代表氧原子。下列有关乙醇的说法不正确 的是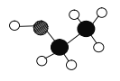
A.乙醇的化学式为C2H6O
B.乙醇的相对分子质量为 46
C.乙醇中碳元素和氢元素的质量比为 12∶1
D.乙醇是一种有机物
难度: 简单查看答案及解析
-
工业上用氮气合成氨气(NH3),用氨气生产硝酸,相关反应如下:
①
 ②
②
③
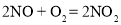 ④
④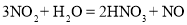
下列说法不正确的是
A.反应①③属于化合反应
B.反应②中 X 的化学式为 N2
C.反应④中氮元素的化合价既有升高又有降低
D.NO 和 NO2 可以相互转化
难度: 简单查看答案及解析
-
逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.单质是由一种元素组成的纯净物,则由一种元素组成的纯净物一定是单质
B.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
C.氧化物中含有氧元素,则含有氧元素的化合物一定是氧化物
D.置换反应有单质生成,则有单质生成的反应一定是置换反应
难度: 中等查看答案及解析
-
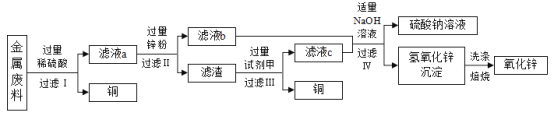
某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是
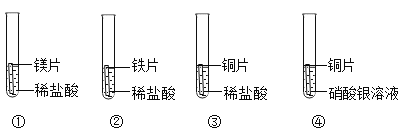
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
难度: 简单查看答案及解析
-
下列图象表示的化学反应过程,与实际情况相符合的是,(说明:①至④对应的每组实验其他条件均相同)
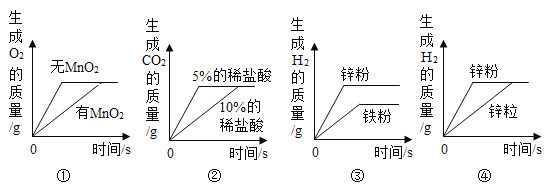
A.图①表示等质量等溶质质量分数的过氧化氢溶液分别在有、无MnO2的条件下反应
B.图②表示等质量的碳酸钙粉末分别与足量的溶质质量分数为 5%和 10%的稀盐酸反应
C.图③表示等质量的锌粉和铁粉分别与足量的等溶质质量分数的稀盐酸反应
D.图④表示等质量的锌粉和锌粒分别与足量的等溶质质量分数的稀盐酸反应
难度: 中等查看答案及解析