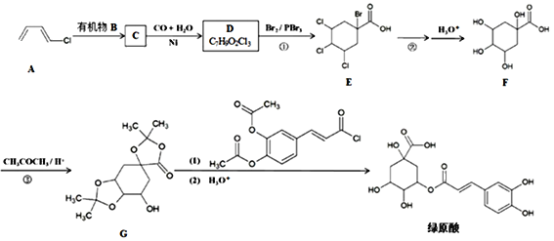
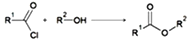
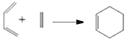-
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A.铁粉和碳粉的混合物可作食品抗氧化剂
B.共享单车利用太阳能发电完成卫星定位,有利于节能环保
C.补铁剂与维生素C共同服用可提高补铁效果
D.光导纤维、醋酸纤维、硝酸纤维都是以纤维素为原料的化工产品
难度: 简单查看答案及解析
-
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A. 海水中含有钾元素,只需经过物理变化能得到钾单质
B. 海水蒸发制海盐的过程中只发生了化学变化
C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na
D. 利用潮汐发电是将化学能转化为电能
难度: 简单查看答案及解析
-
2019年12月以来,我国部分地区突发的新冠病毒肺炎威胁着人们的身体健康。下列有关说法不正确的是
A.医疗上常用75%(体积分数)的酒精作消毒剂
B.高温可以杀死新冠肺炎病毒
C.“84”消毒液(主要成分是次氯酸钠)能有效杀死新型冠状病毒,为了提升消毒效果,可以与洁厕灵(主要成分为盐酸)混合使用
D.过氧化氢、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
难度: 中等查看答案及解析
-
下列物质的名称正确的是( )
A.2CaSO4·H2O:生石膏
B.CO(NH2)2:尿素
C.C6H10O5:纤维素
D.
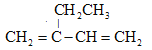 :2-乙基-1,4-丁二烯
:2-乙基-1,4-丁二烯难度: 中等查看答案及解析
-
下列有关有机化合物的性质和用途的说法正确的是( )
A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应
B.乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键
C.乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒
D.淀粉、油脂、蛋白质都属于高分子化合物
难度: 中等查看答案及解析
-
下列说法正确的是
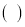
A.在电解法精炼铜的过程中,若转移1 mol电子,则阳极溶解32 g粗铜
B.仅升高平衡体系
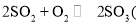 正反应放热
正反应放热 的温度,正、逆反应速率均加快
的温度,正、逆反应速率均加快C.反应
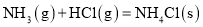 常温下能自发进行,则该反应的
常温下能自发进行,则该反应的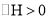
D.
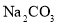 溶液中加入少量
溶液中加入少量 固体,
固体,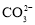 水解程度减小,溶液pH减小
水解程度减小,溶液pH减小难度: 中等查看答案及解析
-
下列各组物质中能够发生反应,而且甲为取代反应,乙为加成反应的是
甲
乙
A
甲烷与氯水(光照)
乙烯与溴的四氯化碳溶液
B
苯与液溴(催化剂)
苯与氢气(加热、催化剂)
C
乙醇与乙酸的酯化反应(加热,催化剂)
乙酸乙酯的水解反应(催化剂)
D
葡萄糖与银氨溶液(水浴加热)
氯乙烯与氢气反应(催化剂)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列实验操作和现象正确的是
操作
现象
结论
A
向Na2S溶液中滴加足量稀盐酸
有气泡生成
非金属性Cl>S
B
溶有SO2的BaCl2溶液中通入气体X
有白色沉淀生成
X一定是Cl2
C
向稀硫酸酸化的H2O2溶液中滴入FeCl2溶液
溶液变黄色
氧化性H2O2>Fe3+
D
向稀硫酸中加入铜片,然后通入Cl2加热
先无明显现象,通入加热后变蓝
氧化性:稀硫酸>Cu2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有关X、Y、Z、W四种金属进行如下实验:
①
将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀
②
将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈
③
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z
根据以上事实,下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,且X做负极
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA
B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA
C.含7.8gNa2S的溶液中阴离子总数大于0.1NA
D.向100mL1mol•L-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA
难度: 困难查看答案及解析
-
某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:
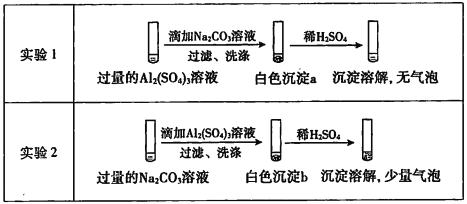
下列分析不正确的是
A.实验I中,白色沉淀a是Al(OH)3
B.实验2中,白色沉淀b含有CO32-
C.实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D.检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
难度: 中等查看答案及解析
-
钼(Mo)的最重要用途是作为铁合金的添加剂,用CO还原MoO3制备单质Mo的装置如图所示(尾气处理装置已省略)。下列说法正确的是
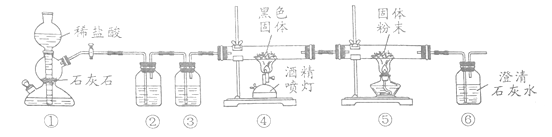
A.装置①用于制备CO2,其中石灰石可用纯碱替代
B.装置②中盛有饱和碳酸钠溶液,以除去CO2中的HCl气体
C.在装置④中生成了钼单质
D.装置⑥中的现象不能达到检验MoO3是否被CO还原的目的
难度: 困难查看答案及解析
-
NO氧化反应2NO(g)+O2(g) ⇌2NO2(g)分两步进行:I.2NO(g) ⇌N2O2(g) ∆H1;II.N2O2(g)+O2(g) ⇌2NO2(g) ∆H2,其反应过程能量变化示意图如图,下列说法不正确的是

A.由于 Ea1<Ea2,决定化学反应速率快慢的是反应Ⅱ
B.图示过程中,反应物断键吸收的能量小于生成物形成所释放的能量
C.升高温度,2NO(g)+O2(g) ⇌2NO2(g)反应速率一定加快
D.其它条件不变,升高温度,2NO(g)+O2(g) ⇌2NO2(g)平衡一定逆向移动
难度: 中等查看答案及解析
-
对利用甲烷消除NO2污染进行研究,CH4+2NO2
 N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表:
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表:组别
温度
时间/min
n/mol
0
10
20
40
50
①
T1
n(CH4)
0.50
0.35
0.25
0.10
0.10
②
T2
n(CH4)
0.50
0.30
0.18
……
0.15
下列说法正确的是
A.0~10min内,CH4的降解速率①>②
B.40min时,表格中T2对应的数据为0.18
C.由实验数据可知实验控制的温度T1<T2
D.①中,0~20min内NO2的降解速率为0.0125mol·L-1·min-1
难度: 中等查看答案及解析
-
工业上联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。 实验过程中取样测丙溶液的 pH 值,pH 试纸显红色。下列有关说法正确的是
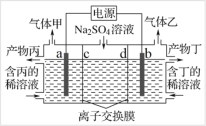
A.a 电极的电极反应式为:2H+ + 2e- = H2↑
B.联合生产过程中需添加补充 Na2SO4
C.离子交换膜 d 为阴离子交换膜
D.每转移 0.1 mol 电子,产生 1.12 L 的气体乙
难度: 中等查看答案及解析
-
一定温度下,将1 mol X和3 mol Y置于2 L的恒容密闭容器中,发生反应:X(g)+3Y(g)⇌2Z(g),反应过程中部分数据如表所示:
t/min
0
10
20
30
40
p/kPa
32
28.8
27.2
26.88
26.88
下列说法正确的是
A.10min时,用Y表示的平均反应速率为0.03 mol·L-1·min-1
B.X和Y的转化率之比保持不变时,可判断反应达到平衡状态
C.平衡状态时,c(Z)=0.32 mol·L-1
D.用气体分压代替物质的量浓度计算该反应的平衡常数,数值不变
难度: 中等查看答案及解析
-
C1O2作为一种强氧化剂,是国际上公认的高效消毒灭菌剂,但因其易爆有毒,常用NaClO2替代。常温下,将NaOH固体加入到由0.1molC1O2溶于水配成的1L溶液中。溶液pH及部分组分含量变化曲线如图,下列叙述不正确的是
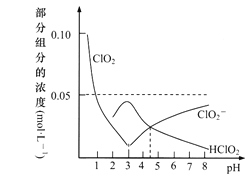
(已知:2C1O2+H2O
 HC1O2+H++C1O3-)
HC1O2+H++C1O3-)A.Ka(HClO2)≈10-4.5
B.不能用pH试纸测该溶液的pH
C.酸性:HClO2<HClO3,氧化性:HClO2>HClO3
D.该图像上任何一点,都有c(C1O2-)+c(HC1O2)+c(C1O3-)=0.1mol·L-1
难度: 中等查看答案及解析
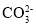 +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑
 [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O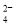 (aq) K=6.31×10-17。
(aq) K=6.31×10-17。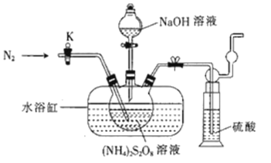
 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2 )。
)。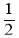 N2(g)+
N2(g)+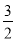 H2(g)⇌NH3(g)标准平衡常数
H2(g)⇌NH3(g)标准平衡常数 ,其中
,其中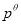 为标准压强(1×105Pa),
为标准压强(1×105Pa),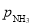 、
、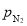 和
和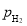 为各组分的平衡分压,如:
为各组分的平衡分压,如: ,p为平衡总压,
,p为平衡总压,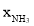 为平衡系统中NH3的物质的量分数。
为平衡系统中NH3的物质的量分数。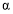 ,则
,则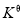 =_________(用含
=_________(用含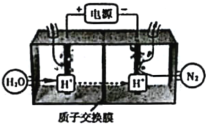
 )
)