-
如何应对气候变化、提升经济绿色水平,实现人类可持续发展是目前世界各国共同探究的课题。为达成“同呼吸,共奋斗”全国各地为治理雾霾广泛开展了一系列活动。下列活动不符合这一主题的是
A. 机动车实行限行措施是减少雾霾的途径之一
B. 积极推广风能、太阳能、氢能等新型能源的使用
C. 通过吸收空气中CO2并利用廉价能源合成汽油可推广“绿色自由”计划
D. 将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法
难度: 中等查看答案及解析
-
下列化学用语的理解正确的是
A. 电子式:
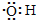 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子B. 离子结构示意图 :
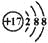 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-C. 比例模型
 :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子D. 聚丙烯的结构简式:
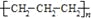
难度: 中等查看答案及解析
-
以色列科学家Daniel Shechtman因发现准晶体(介于晶体和非晶体之间的固体)获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
A. n(烧碱)<n(稀硝酸)<n(盐酸) B. n(稀硝酸)<n(烧碱)<n(盐酸)
C. n(盐酸)<n(稀硝酸)<n(烧碱) D. n(烧碱)<n(盐酸)<n(稀硝酸)
难度: 困难查看答案及解析
-
下列物质与其用途完全符合的有多少条?
①干冰—人工降雨;②Na2CO3—制玻璃;③Fe2O3—红色油漆或涂料;④Al2O3—耐火材料;⑤NaClO—消毒剂;⑥NaCl—制纯碱;⑦KAl(SO4)2—消毒、净水;
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序列
参加反应的物质
生成物
①
MnO4-……
Cl2、Mn2+……
②
Cl2 、FeBr2
FeCl3、FeBr3
③
KMnO4、H2O2、H2SO4
K2SO4 、MnSO4……
A. 第①组反应中生成0.5mol Cl2,转移电子1mol
B. 第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C. 第③组反应的其余产物为H2O和 O2
D. 氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+> Br2
难度: 困难查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,A原子在元素周期表中原子半径最小,B原子最外层电子数是电子层数的3倍,D与B属于同一主族,CA2是一种储氢材料。下列叙述正确的是
A. 元素B的单质与化合物A2D反应能生成D的单质
B. 工业上利用铝热反应可制得单质C
C. 原子B、C、D半径的大小顺序:D>C>B
D. 一定条件下,过量的B单质与D单质直接生成BD3
难度: 中等查看答案及解析
-
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的溶液,可以发生如图转化,下列说法正确的是
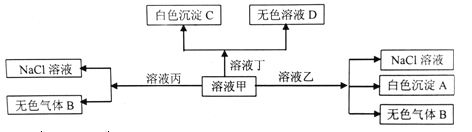
A. 甲为HCl,乙为NaHCO3
B. 溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42-
C. 在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O
D. 白色沉淀A可能溶解在溶液D中
难度: 困难查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
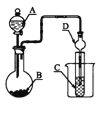
A. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
B. 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
D. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述中正确的是
A. CH4与P4的分子结构都是正四面体形,因此在NA个CH4分子或P4分子中都含有4NA个共价键
B. 在含NA个硅原子的二氧化硅晶体中含有4NA个Si-O键
C. 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2NA个电子
D. NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.C2H4、C3H6和
 中均含有碳碳双键
中均含有碳碳双键D.糖类、油脂和蛋白质均可发生水解反应
难度: 简单查看答案及解析
-
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A.HCN既是氧化剂又是还原剂
B.CaCN2中含有非极性键
C.CO为氧化产物,H2为还原产物
D.每消耗5g CaCO3生成1.12L CO2
难度: 中等查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+) + c(H+) = c(OH-) + c(CH3COO-)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
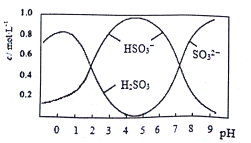
④若将适量CO2通入0.1 mol·L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32ˉ)+ c(HCO3ˉ)=" 0.1" mol·L-1
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;
则有:Ka·Kh=Kw
A. ①②④⑤ B. ②④ C. ②⑤ D. ①②③④
难度: 困难查看答案及解析
-
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是
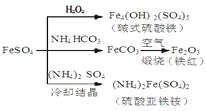
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
难度: 中等查看答案及解析
-
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)
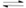 Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:温度/℃
25
80
230
平衡常数
5×104
2
1.9×10﹣5
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)
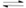 Ni(s)+4CO(g)的平衡常数为2×10﹣5
Ni(s)+4CO(g)的平衡常数为2×10﹣5C. 在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D. 80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L
难度: 困难查看答案及解析
-
全钒液流电池是一种新型的绿色环保储能电池,该电池性能优良,其电池总反应为:
V3++VO2++H2O
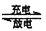 VO2++2H++V2+。下列叙述正确的是 ( )
VO2++2H++V2+。下列叙述正确的是 ( )A. 放电过程中电解质溶液中阴离子移向正极
B. 放电时每转移0.5mol电子,负极有0.5mol V2+被氧化
C. 充电时阳极附近溶液的酸性减弱
D. 充电时阳极反应式为:VO2++2H++e-=VO2++H2O
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符的是
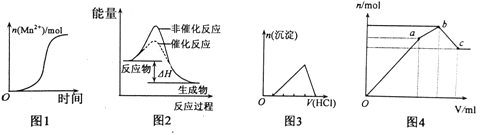
A. 图1表示10mL 0.01mol·L-1KMnO4酸性溶液与过量的0.1mol·L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
B. 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
D. 图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
难度: 困难查看答案及解析
 COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
 Fe(OH)3+3H+的平衡常数为
Fe(OH)3+3H+的平衡常数为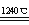 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。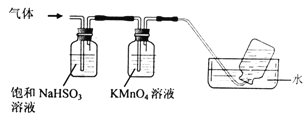
 2CH3CH2OH+2CO2↑)。
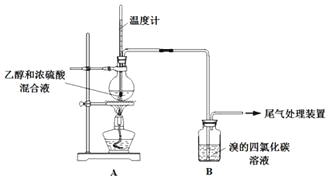
2CH3CH2OH+2CO2↑)。 CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。