-
含有氢键的共价化合物是
A.NaCl B.CO2
C.HF D.NaOH
难度: 中等查看答案及解析
-
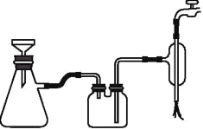
配制一定物质的量浓度的 NaOH 溶液时,下列仪器不是必须用到的是
A.
 B.
B. C.
C.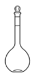 D.
D.
难度: 简单查看答案及解析
-
下列属于电解质且能导电的是
A.稀硫酸 B.液态氯化氢 C.熔融氯化钾 D.乙醇
难度: 简单查看答案及解析
-
反应 2Na2O2+4HCl=4NaCl+O2↑+2H2O 中,氧化产物是
A.Na2O2 B.NaCl C.O2 D.H2O
难度: 简单查看答案及解析
-
下列物质的名称或符号不正确的是
A.泡花碱:Na2SiO3 B.摩尔盐:(NH4)2SO4·FeSO4·6H2O
C.碳铵:NH4HCO3 D.新戊烷:(CH3)2CHCH2CH3
难度: 中等查看答案及解析
-
下列表示正确的是
A.甲基的电子式:
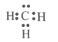 B.35Cl 的结构示意图:
B.35Cl 的结构示意图: 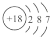
C.CO2 的比例模型:
 D.N2 的结构式:N≡N
D.N2 的结构式:N≡N难度: 简单查看答案及解析
-
下列说法正确的是
A.1H2 和 2H2 互为同位素 B.HCOOCH3 和 CH3OCHO 是同种物质
C.淀粉和纤维素互为同分异构体 D.O2 和 O
 互为同素异形体
互为同素异形体难度: 中等查看答案及解析
-
下列有关说法正确的是
A.丙三醇俗称甘油,吸湿性强,可用于护肤
B.自来水净化过程中常加入明矾的作用是杀菌消毒
C.铝线用于高压电线,主要原因是导电性比Cu、Ag强
D.NaHCO3受热易分解,所以可用于制胃酸中和剂
难度: 简单查看答案及解析
-
下列方法不合理的是
A.工业上用 H2 还原 SiCl4 制得高纯度的硅
B.将氯气通入石灰水可制得漂白粉
C.硫酸工业上在SO2进入接触室前必须对气体进行净化,防止接触室的催化剂中毒
D.芒硝晶体(Na2SO4·10H2O)白天在阳光下暴晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能
难度: 中等查看答案及解析
-
下列说法正确的是
A.Mg3N2晶体中既有离子键又有共价键
B.HI气体受热分解的过程中,只需克服分子间作用力
C.SiCl4 和SiO2的化学键类型相同,气化时需克服微粒间的作用力类型也相同
D.某化合物在熔融态能导电,可确定一定含有离子键
难度: 简单查看答案及解析
-
下列说法正确的是
A.分馏石油可以得到汽油、柴油、植物油和润滑油
B.棉花和蚕丝的主要成分都是纤维素
C.水煤气可用来合成液态烃及甲醇等含氧有机物
D.糖类、油脂、蛋白质都属于有机高分子化合物
难度: 简单查看答案及解析
-
下列有关实验操作或描述中正确的是
A.将NaNO3和 KCl 的混合液加热并浓缩有晶体析出,趁热过滤,可分离出 NaCl
B.纸层析法只能用于分离有色物质,否则无法看到色斑
C.萃取时缓慢振摇分液漏斗几次后须将分液漏斗正立放置,然后打开上口玻璃塞放气
D.除去苯中的苯酚,可以“在苯中加入适量溴水、振荡,过滤并除去沉淀”的方法
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.用NaHCO3溶液检验水杨酸中的羧基:
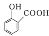 +2HCO
+2HCO →
→ +2CO2↑+2H2O
+2CO2↑+2H2OB.向Na2S2O3溶液中加入稀硫酸:2S2O
 +4H+=SO
+4H+=SO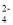 +3S↓+2H2O
+3S↓+2H2OC.过量SO2通入Na2S溶液中出现黄色浑浊:5SO2+2S2-+2H2O=3S↓+4HSO
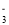
D.偏铝酸钠溶液中通入过量CO2:2AlO
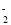 +CO2+3H2O=2Al(OH)3↓+CO
+CO2+3H2O=2Al(OH)3↓+CO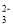
难度: 中等查看答案及解析
-
下列有关有机物的叙述正确的是
A.一定条件下,乙酸乙酯、淀粉、蛋白质、糖类都能发生水解。
B.只有不同种类的氨基酸之间才能形成多肽。
C.往皂化反应后的溶液中加入热的饱和食盐水,上层析出固体物质。
D.葡萄糖溶液中加入新制氢氧化铜悬浊液可看到有砖红色沉淀生成。
难度: 中等查看答案及解析
-
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。下列说法不正确的
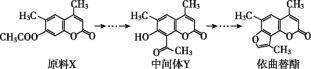
A.原料 X 与中间体 Y 既不是同系物,也不是同分异构体
B.原料 X 可以使酸性 KMnO4 溶液褪色
C.中间体 Y 能发生加成、取代、氧化、还原、聚合反应
D.依曲替酯分子式为 C14H12O3,1 mol 依曲替酯最多能与 2 mol NaOH 发生反应
难度: 中等查看答案及解析
-
短周期四种主族元素 X、Y、Z、Q 在周期表中的位置如图所示。X、Y、W 的最外层电子数之和与 Q 原子核内质子数相等。下列说法中不正确的是
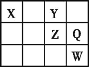
A.简单离子半径(r):r(Wm-)> r(Zn-)> r(Qm-)
B.元素 Z 和 Y 都可能显-1 价
C.可以推测HWO4是 W 的最高价氧化物对应的水化物
D.Y 的氢化物的沸点一定高于 X 的氢化物沸点
难度: 中等查看答案及解析
-
下列说法正确的是
A.向0.1 mol·L−1的氨水中加少量硫酸铵固体,则溶液中
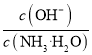 增大
增大B.常温下,0.1 mol·L−1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A−)+Kw
C.向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液得到沉淀的物质的量最多为 2 mol
D.将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
难度: 中等查看答案及解析
-
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池(Ni-MH 电池)正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的是

A.放电时电池内部 H+向负极移动
B.充电时,将电池的负极与外接电源的正极相连
C.放电时负极区溶液的 pH 增大
D.充电时阳极反应式为 Ni(OH)2+OH--e-=NiOOH+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.稀K2Cr2O7溶液中存在平衡:Cr2O
 (橙色)+H2O
(橙色)+H2O 2CrO
2CrO (黄色)+2H+,达平衡后再加少量水,主要由于水的浓度增大,平衡向右移动
(黄色)+2H+,达平衡后再加少量水,主要由于水的浓度增大,平衡向右移动B.实验室制氢气,为了加快反应速率,可向稀硫酸中加少量Cu(NO3)2固体
C.Cl2+H2O
 H++Cl-+HClO,可用排饱和食盐水收集氯气,若改用排碳酸钠溶液效果更好
H++Cl-+HClO,可用排饱和食盐水收集氯气,若改用排碳酸钠溶液效果更好D.吸热反应“TiO2(s)+2Cl2(g)
 TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S>0
TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S>0难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,2.24L NO 和 2.24L O2 混合后所含分子数为 0.15NA
B.标准状况下,2.24L 氯气充分反应时转移电子一定为 2NA
C.3.1 g P4 中的共价键数目为 0.15NA
D.120gNaHSO4固体中含有 H+的数目为 NA
难度: 中等查看答案及解析
-
三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g)
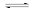 SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是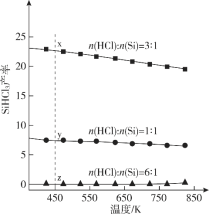
A. 降低压强有利于提高SiHCl3的产率
B. 制备SiHCl3的反应为放热反应
C. 温度为450 K,平衡常数:K(x)>K (y)>K (z)
D. 增加HCl的用量,SiHCl3的产率一定会增加
难度: 中等查看答案及解析
-
已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示。下列说法正确的是
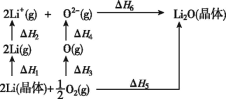
A.ΔH1<0,ΔH2>0
B.ΔH3<0,ΔH4<0
C.ΔH1+ΔH2+ΔH3+ΔH4-ΔH5 +ΔH6=0
D.若是钠晶体,则ΔH1将增大
难度: 中等查看答案及解析
-
常温下,向某浓度的 H2A(二元弱酸)溶液中逐滴加入某浓度的 KOH 溶液,所得溶液中 H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是
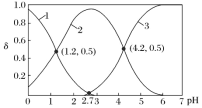
A.由图可知,H2A的Ka1=10-1.2
B.曲线3代表A2-物质的量分数
C.向H2A溶液中滴加氢氧化钾溶液至pH为4.2时:c(K+)+c(H+)=3c(A2-)+c(OH-)
D.pH=4时,溶液中存在下列关系:c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
某兴趣小组以含钴废料(含少量 Fe、Al 等杂质)制取 CoCl2·6H2O 的一种实验设计流程如下,下 列说法不正确的是
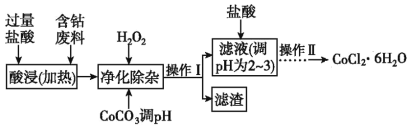
已知:25℃时,部分阳离子以氢氧化物形成沉淀时,溶液的 pH 见下表:
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
开始沉淀(pH)
1.9
7.0
7.6
3.4
完全沉淀(pH)
3.2
9.0
9.2
4.7
A.加 CoCO3 调 pH,主要目的是除去 Fe3+,所以需控制 pH 为 3.2~7.6
B.加盐酸调 pH 为 2~3,目的是抑制 CoCl2 的水解
C.操作Ⅱ的过程包括蒸发浓缩、冷却结晶、过滤、洗涤和干燥
D.可以通过减慢结晶速率的方法来得到较大颗粒的 CoCl2·6H2O 晶体
难度: 中等查看答案及解析
-
某红色固体粉末可能是Cu、Cu2O、Fe2O3中的一种或几种。为探究其组成,称取a g该固体粉末样品,用过量的稀硫酸充分反应后(已知:Cu2O+2H+=Cu2++Cu+H2O),称得固体质量为b g。则下列推断不合理的是
A. 反应后溶液中大量存在的阳离子最多有3种
B. 向反应后的溶液中加入一定量的NaNO3,可能使b g固体完全溶解
C. 若b=
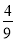 a,则红色固体粉末一定为纯净物
a,则红色固体粉末一定为纯净物D. b的取值范围:0<b≤a
难度: 困难查看答案及解析
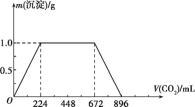
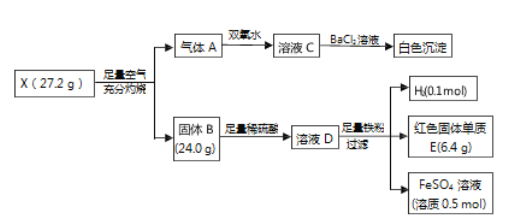
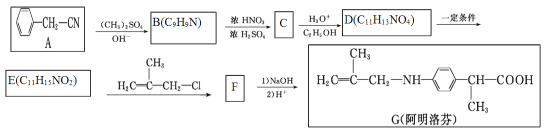
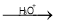 RCOOH
RCOOH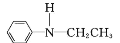 (用流程图 表示,无机试剂任选)_____。
(用流程图 表示,无机试剂任选)_____。 CH2=CH2
CH2=CH2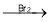 BrCH2-CH2Br
BrCH2-CH2Br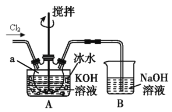
 C3H6(g)+H2(g) ΔH1。
C3H6(g)+H2(g) ΔH1。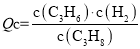 保持不变
保持不变
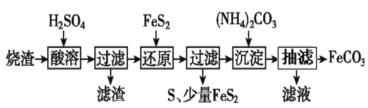
 +16H+。
+16H+。