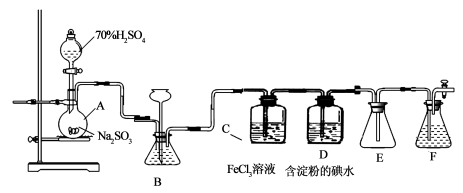
-
下列对化学知识概括合理的是
A.酸性氧化物都是非金属氧化物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
D.熔融状态能导电的物质一定是离子化合物
难度: 简单查看答案及解析
-
下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.需要通过化学反应才能从海水中获得食盐和淡水
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.工业制粗硅涉及氧化还原反应
难度: 简单查看答案及解析
-
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为
A.纯盐酸、空气、硫酸、干冰
B.蒸馏水、氨水、碳酸氢钠、二氧化硫
C.胆矾、盐酸、铁、碳酸钙
D.生石灰、漂白粉、氯化铜、碳酸钠
难度: 简单查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性是顺序为SO2 > I- > Fe2+ > H2O2> Cl-,则下列反应不可能发生的是
A.2Fe2++Cl2=2Fe3++2Cl-
B.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.SO2+I2+2H2O=H2SO4+2HI
难度: 中等查看答案及解析
-
下列说法正确的是
A.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
B.不能用瓷坩埚加热熔融氢氧化钠固体
C.将SO2通入品红溶液或溴水均能使它们褪色,证明SO2有漂白性
D.向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe2+
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数,下列说法中不正确的是
A.一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B.1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D.125gCuSO4•5H2O晶体中含有0.5NA个Cu2+
难度: 中等查看答案及解析
-
下列叙述正确的是
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥H2、SO2等气体,但不能干燥NH3、NO2等气体
③Na2O2与CO2反应生成Na2CO3和O2,SO2和Na2O2反应生成Na2SO3和O2
④足量的硫单质与64g铜反应,有2mol电子发生转移
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质
A.①④⑤ B.①⑤⑥ C.②③④ D.④⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强
B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为:Fe3+ > Cu2+ > Fe2+
C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和反应 2C-+ B2=2B-+C2都能发生
D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
难度: 中等查看答案及解析
-
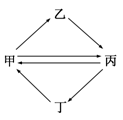
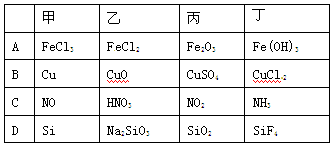
下列各组物质按下图所示转化关系每一步都能一步实现的是
难度: 简单查看答案及解析
-
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的
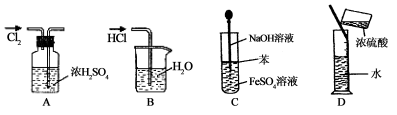
A.干燥Cl2 B.吸收HCl
C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
难度: 中等查看答案及解析
-
下列反应最终能生成Fe3+的化合物的是
①过量Fe与HNO3 ②铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
Mn2++Cl2↑+2H2O
C.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
D.Fe3O4与稀HNO3反应:Fe3O4+8H+ =Fe2++2Fe3++4H2O
难度: 中等查看答案及解析
-
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是
A.Na+、H+、Cl-、NO3- B.Na+、Mg2+、Cl-、SO42-
C.K+、Ba2+、OH-、I- D.Cu2+、CO32-、Br-、ClO-
难度: 中等查看答案及解析
-
高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3 +3ClO-+4OH- = 2FeO42- +3Cl-+5H2O ,
干法制备的主要反应方程为:2FeSO4 +6Na2O2 = 2Na2FeO4 +2Na2O +2Na2SO4 +O2↑
则下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法中FeO42—是氧化产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质
难度: 中等查看答案及解析
-
大胆科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是
A.探究SO2与Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能生成NaOH和H2O2
C.探究浓H2SO4与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性变化所致,还是HClO的漂白性
难度: 中等查看答案及解析