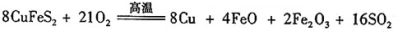-
(14分)I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ; ②Fe2++O2+H+
4H++2Fe2++4SO42- ; ②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S; ④2S+3O2+2H2O
3Fe2++2S; ④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是___________。 在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是___________。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为8CuFeS2+ 21O2  8Cu+4FeO+2Fe2O3+16SO2.若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
8Cu+4FeO+2Fe2O3+16SO2.若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
-
(13分)I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42- ;
4H++2Fe2++4SO42- ;
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来
II、在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是_____________________________ 。在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________ _。(提示:碘元素被氧化成IO3—)从以上实验可知,ClO—、I2、IO3—的氧化性由强到弱的顺序是 。
III、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
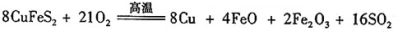
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
-
煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++______;
4H++2Fe2++______;
②4Fe2++O2+4H+ 4Fe3++______;
4Fe3++______;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2
4H++2 .
.
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是______.
(3)观察上述反应,FeS2最终转化为______从煤炭中分离出来.
-
(8分) 煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O  4H++2Fe2++________;
4H++2Fe2++________;
②4Fe2++O2+4H+ 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
已知:FeS2中的铁元素为+2价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来。
-
Ⅰ.煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO
4H++2Fe2++4SO ;
;
②Fe2++O2+H+ Fe3++________;
Fe3++________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO
4H++2SO 。
。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整_______。
(2)反应③的还原剂是__________________。
(3)观察上述反应,硫元素最终转化为____________从煤炭中分离出来。
Ⅱ.在淀粉KI溶液中,滴入少量NaClO溶液,溶液立即变蓝,有关反应的离子方程式是____________________________。在上述蓝色溶液中,继续滴加足量的NaClO溶液,蓝色逐渐消失,有关反应的离子方程式是_______________________。(提示:碘元素被氧化成IO )从以上实验可知,ClO-、I2、IO
)从以上实验可知,ClO-、I2、IO 的氧化性由强到弱的顺序是________________。
的氧化性由强到弱的顺序是________________。
Ⅲ.工业上用黄铜矿( CuFeS2)冶炼铜,副产品中有SO2 ,冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是________(填元素符号)。当生成0.8 mol 铜时,此反应转移的电子数目是________。
8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是________(填元素符号)。当生成0.8 mol 铜时,此反应转移的电子数目是________。
-
(8分)I、煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42-
4H++2Fe2++4SO42-
②Fe2++O2+H+ Fe3++____________;
Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整。
(2)反应③的还原剂是 。
(3)观察上述反应,硫元素最终转化为 从煤炭中分离出来。
II、工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是 (填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是 。
-
自然界中的许多金属元素都能以硫化物的形式存在,硫铁矿(FeS2)就是其中一种,在矿区,开采出的硫铁矿石暴露在空气和水中,会发生下图所示转化。回答下列问题:

⑴FeS2的氧化产物Fe2(SO4)3易______,会使地下水和土壤呈______性;如果矿区中的水流或降雨不断淋洗硫铁矿,FeS2最终转化为____________。
⑵写出FeS2的电子式:____________。
⑶写出图中①③两个反应的离子方程式:
①____________________________________,
③____________________________________。
-
从矿物学资料查得,一定条件下自然界存在如下反应:
 。下列说法正确的是( )
。下列说法正确的是( )
A. 既是氧化产物又是还原产物
既是氧化产物又是还原产物
B.5 mol  发生反应,有10 mol电子转移
发生反应,有10 mol电子转移
C.产物中 有一部分是氧化产物
有一部分是氧化产物
D.FeS2只作还原剂
-
从矿物学资料查得,一定条件下自然界存在如下反应:
 。下列说法正确的是
。下列说法正确的是
A、 既是氧化产物又是还原产物
既是氧化产物又是还原产物
B、5 mol  发生反应,有10 mol电子转移
发生反应,有10 mol电子转移
C、产物中 有一部分是氧化产物
有一部分是氧化产物
D、FeS2只作还原剂
-
生物法(加入脱硫细菌)净化含硫废气时发生如下反应:CH3COOH +SO42-=2HCO3-+H2S。下列有关说法正确的是
A. CH3COOH是氧化剂 B. SO42-被氧化
C. H2S的酸性弱于H2CO3 D. 该反应属于复分解反应
4H++2Fe2++4SO42-
Fe3++____________;
3Fe2++2S;
4H++2SO42-。
8Cu + 4FeO + 2Fe2O3 + 16SO2