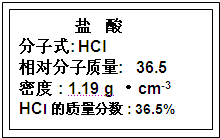
-
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中( )
A.一定有SO42-
B.还可能有CO32-
C.一定无Ag+
D.可能有SO42-或Ag+难度: 中等查看答案及解析
-
下列实验基本操作或实验注意事项中,主要是出于实验安全考虑的是( )
A.实验剩余的药品不能放回原试剂瓶
B.可燃性气体点燃前验纯
C.气体实验装置在实验前进行气密性检查
D.滴管不能交叉使用难度: 中等查看答案及解析
-
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色难度: 中等查看答案及解析
-
油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装.下列气体中最不应该充入的是( )
A.氮气
B.二氧化碳
C.空气
D.氧气难度: 中等查看答案及解析
-
下列实验中,合理的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.用100mL量筒量取5.2mL盐酸
C.用托盘天平称取25.28gNaCl固体
D.用100mL容量瓶配制125mL0.1mol•L-1盐酸难度: 中等查看答案及解析
-
下列溶液中Cl-浓度最小的是( )
A.200mL2mol/LMgCl2溶液
B.1000mL2.5mol/LNaCl溶液
C.300mL5mol/LKClO3溶液
D.250mL1mol/LAlCl3溶液难度: 中等查看答案及解析
-
人们会利用纳米级(1-100nm)微粒物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用.将纳米级微粒物质溶解于液体分散剂中形成一种分散系,对该分散系及分散质颗粒的叙述中正确的是( )
A.该分散系为溶液
B.该分散系能发生丁达尔效应
C.该分散系属于悬浊液
D.该分散系放置一段时间可能很快出现分层现象难度: 中等查看答案及解析
-
以下说法正确的是( )
A.氧化还原反应的特征是化合价发生变化
B.氧化剂在化学反应中被氧化
C.还原剂在反应中发生还原反应
D.氧化剂在同一反应中既可以是反应物,也可以是生成物难度: 中等查看答案及解析
-
悬浊液、乳浊液、溶液和胶体都是( )
A.稳定的液体
B.透明的液体
C.混合物
D.化合物难度: 中等查看答案及解析
-
需加入氧化剂才能发生的变化是( )
A.CO32-→CO2
B.Cl-→Cl2
C.MnO4-→Mn2+
D.Fe3+→Fe2+难度: 中等查看答案及解析
-
下列实验操作或事故处理中,做法不正确的是( )
A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,立即用大量水冲洗,然后涂上硼酸溶液
C.不慎碰翻实验桌上燃着的酒精灯失火,马上用湿布扑灭
D.配制硫酸溶液时,先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸难度: 中等查看答案及解析
-
物理量的符号及其单位都正确的是( )
A.阿伏加德罗常数:NA,mol
B.摩尔质量:M,g•mol-1
C.气体摩尔体积:Vm,mol•L-1
D.物质的量浓度::C,L•moL-1难度: 中等查看答案及解析
-
下列各项物质能导电且属于强电解质的是( )
A.固态NaCl
B.熔态MgCl2
C.Al
D.液态H2SO4难度: 中等查看答案及解析
-
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为( )
A.1:1:1
B.1:2:3
C.3:2:1
D.6:3:2难度: 中等查看答案及解析
-
在同温同压下,11.5g气体A所占的体积和8gO2 所占的体积相同,则气体A的相对分子质量为( )
A.46
B.28
C.44
D.64难度: 中等查看答案及解析
-
1molN2和44gCO2的气体体积,前者和后者的关系是( )
A.大于
B.等于
C.小于
D.不能确定难度: 中等查看答案及解析
-
下列说法正确的是( )
A.1molO的质量是16g/mol
B.Na+的摩尔质量为22g/mol
C.CO2的摩尔质量为44g/mol
D.氢的摩尔质量为2g/mol难度: 中等查看答案及解析
-
下列仪器常用于物质分离的是( )

A.①③⑤
B.②③⑤
C.②④⑤
D.①②⑥难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.铁与醋酸反应:Fe+2H+=Fe2++H2↑
B.硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO4↓
C.碳酸钙溶液与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.铜与硝酸银溶液反应:Cu+Ag+=Ag+Cu2+难度: 中等查看答案及解析
-
不能用Ba2++SO42-═BaSO4↓表示的反应是( )
A.硫酸钾溶液与氢氧化钡溶液反应
B.硫酸溶液与氢氧化钡溶液反应
C.硫酸溶液与硝酸钡溶液反应
D.氯化钡溶液与硫酸铵溶液反应难度: 中等查看答案及解析
-
将VLHCl气体(标准状况下)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为( )
A.V/22400mol•L-1
B.1000V/22.4mol•L-1
C.V/22.4mol•L-1
D.V/11.2mol•L-1难度: 中等查看答案及解析
-
下列各无色透明的水溶液中,能大量共存的离子组是( )
A.Na+、Mg2+、NO3-、Cl-
B.Al3+、K+、OH-、NO3-
C.Na+、Ba2+、Cl-、SO42-
D.H+、K+、SO42-、Fe3+难度: 中等查看答案及解析
-
设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
A.1molNH3所含有的原子数为NA
B.常温常压下,22.4L氧气所含的原子数为2NA
C.常温常压下,48gO3所含的氧原子数为3NA
D.1L0.1mol/LNaCL溶液中所含的Na+为NA难度: 中等查看答案及解析
-
下列微粒不具有还原性的是( )
A.S
B.H+
C.Fe2+
D.Cl-难度: 中等查看答案及解析