-
判断下列有关化学基本概念的依据正确的是
A.氧化还原反应:元素化合价是否变化 B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小 D.氧化物:含氧化合物
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是
A.通过电泳实验证明胶体带电
B.通常利用丁达尔效应区别溶液与胶体
C.渗析实验说明胶体粒子能透过半透膜
D.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体
难度: 简单查看答案及解析
-
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.次氯酸的电子式:
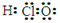
B.质量数为16的氧原子:
C.乙烯的结构简式:
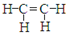
D.碳酸氢根离子的电离方程式: HCO3-+ H2O
H3O++ CO32-
难度: 中等查看答案及解析
-
下列各对物质间的反应既属于氧化还原反应,又属于离子反应的是
A.Zn+H2SO4(稀) B.NaCl+AgNO3(溶液)
C.H2+O2 D.Na2O+H2O
难度: 中等查看答案及解析
-
据报道,科学家最近发现了一种新的粒子,这种粒子是由3个1 H原子核和2个电子构成。下列关于这种粒子的说法中,正确的是
A.它是氢的一种新同位素 B.这种新元素的核电荷数是3
C.它是H2的一种新同素异形体 D.它比一个普通氢分子多—个氢核
难度: 中等查看答案及解析
-
某混合溶液,含以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,分别取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.100mL溶液中含0.01mol CO32- B.Cl-一定存在
C.K+一定存在 D.Ba2+一定不存在,Mg2+可能存在
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
A.(y-2x)/a, B.(y-x)/a, C.(2y-2x)/a, D.(2y-4x)/a。
难度: 中等查看答案及解析
-
下列选项中所涉及到的两个量的一定相等的是
A.11. 2LCl2与4.25gNH3所含有的原子数
B.18.0g重水(D2O)与20gNe所含有的电子数
C.标准状况下36gH2O与1.204×1024个O2分子所占的体积
D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数
难度: 中等查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O、CaO、Al2O3均属于碱性氧化物
B.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.烧碱、纯碱均属于碱
难度: 中等查看答案及解析
-
类比推断法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比推断法是相对的,不能违背客观实际。下列说法正确的是
A.由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3
B.向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3
C.由O2与Li加热生成Li2O,则O2与Na加热生成Na2O
D.有Fe与S加热生成FeS,则Cu与S加热生成Cu2S
难度: 中等查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是
A.用25mL量筒量取12.36mL盐酸, B.用托盘天平称取8.75g食盐,
C.用酸式滴定管量取23.22mL高锰酸钾溶液,D.用广范pH试纸测得某溶液pH为3.5。
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒
B.标准状况下,1.12 L的HCHO所含的原子数是0.2NA
C.1 L0.5mol·L-1Na2CO3 溶液中含有的CO32-数目为0.5NA
D.0.1 mol Na2O2作供氧剂时转移的电子数目是0.2 NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.澄清石灰水与少量小苏打溶液混合:Ca2+ +2OH- +2HCO3- = CaCO3↓+ CO32- + 2H2O
B.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = Al(OH)4-↓+ 4NH4+
C.少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+ CO32-
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论不正确的是
选项 实验操作 实验现象 结论
A 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 2 min后,试管里出现凝胶 酸性:盐酸>硅酸
B 在酒精灯上加热铝箔 铝箔熔化但不滴落 熔点:氧化铝>铝
C 常温下,向浓硫酸中投入铁片 铁片不溶解 常温下,铁不与浓硫酸反应
D 向某溶液中先滴加KSCN溶液,再滴加少量氯水 先无明显现象,后溶液变成血红色 溶液中含有Fe2+,没有Fe3+
难度: 中等查看答案及解析
-
常温,相应条件下,下列各组离子一定能大量共存的是
A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH-
B.无色溶液中:K+、CH3COO-、HCO3-、MnO4-
C.
=1×1014的溶液:Ba2+、Na+、SO32-、NO3-
D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl-
难度: 中等查看答案及解析
-
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br-)=0.4mol/L
难度: 中等查看答案及解析
-
Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
砝码质量
50
20
20
10
5
取用砝码情况
先↓后↑
↓
先↓后↑
↓
先↓后↑
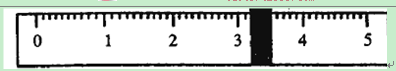
烧杯的质量为________g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置g砝码,将游码的位置移到________g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ、乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移
⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(请填编号)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)定容时俯视溶液的凹液面对所配制的稀硫酸浓度有何影响________
(用偏大、偏小、无影响填写)
难度: 中等查看答案及解析